-
PAU: equilibrio químico. Presión total en el equilibrio y valores de las constantes de equilibrio (655)
A 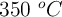 , el NOCl se descompone según la reacción:
, el NOCl se descompone según la reacción:
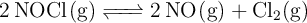
En el equilibrio, las presiones parciales de NOCl, NO y 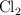 son, respectivamente, 307, 494 y 175 mm de Hg. Calcula la presión total en el equilibrio, el valor de
son, respectivamente, 307, 494 y 175 mm de Hg. Calcula la presión total en el equilibrio, el valor de  y el valor de
y el valor de  .
.
-
Equilibrio químico: moles de producto y formas de aumentar la producción (643)
La constante de equilibrio  para la reacción:
para la reacción:
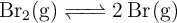
es 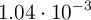 a
a 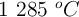 . Un recipiente de 200 mL contiene, una vez alcanzado el equilibrio,
. Un recipiente de 200 mL contiene, una vez alcanzado el equilibrio, 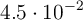 moles de
moles de 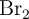 .
.
a) ¿Cuántos moles de Br estarán presentes en el matraz?
b) La reacción de disociación del 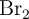 es endotérmica. ¿Qué se puede hacer para aumentar la cantidad de bromo atómico?
es endotérmica. ¿Qué se puede hacer para aumentar la cantidad de bromo atómico?
c) ¿Cuáles de las medidas adoptadas en el apartado anterior afectan al valor de  ?
?
-
Problema moles 0012
Introducimos 5,5 g de oxígeno gaseoso y 12 g de agua vapor en un recipiente de 3 L, a 20 ºC:
a) ¿Cuántos moles de gas hay en el recipiente?
b) ¿Cuántas moléculas de agua?
c) ¿Cuántos átomos de oxígeno?
d) ¿Qué presión ejercen los gases sobre las paredes del recipiente?
Datos: O = 16 ; H = 1 ; 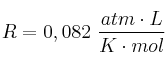
-
Problema moles 0010
La masa molecular de una sustancia es 56 u y en su composición hay dos átomos de elementos distintos. Sabiendo que uno de ellos es oxígeno, ¿cuál es el otro elemento? ¿Qué cantidad de esa sustancia son 0,15 moles?
-
Fórmulas moleculares de varias sustancias
Escribe las moléculas que cumplen con las siguientes características:
a) Cuatro átomos en total y el triple de átomos de hidrógeno que de nitrógeno.
b) Dos átomos de potasio y un átomo de azufre.
c) El mismo número de átomos de hidrógeno que de oxígeno. Cuatro átomos en total.
d) Dos átomos de hidrógeno, un átomo de azufre y el cuádruple de átomos de oxígeno.
 RESUELTO
RESUELTO