-
Cuestión de cinética química: estequiometría y orden de reacción (564)
Para el siguiente equilibrio:
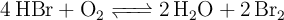
¿Crees que es posible que se trate de un proceso elemental en el coincidan, en la ecuación de velocidad, los órdenes parciales con los coeficientes estequiométricos? ¿Por qué?
-
Constante de velocidad y orden de reacción de un proceso a partir de datos de velocidad (563)
Para una determinada reacción, 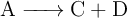 , se ha medido la velocidad a partir de distintas concentraciones iniciales de A y se han registrado los resultados en la tabla:
, se ha medido la velocidad a partir de distintas concentraciones iniciales de A y se han registrado los resultados en la tabla:
![\begin{tabular}{| c | c | } \hline [A] (M)&v (M\cdot s^{-1})\\\hline 0.1&0.15\\\hline 0.2&1.2\\\hline 0.3&4.05\\\hline \end{tabular} \begin{tabular}{| c | c | } \hline [A] (M)&v (M\cdot s^{-1})\\\hline 0.1&0.15\\\hline 0.2&1.2\\\hline 0.3&4.05\\\hline \end{tabular}](local/cache-TeX/45abba4222ed10a7ba933cdf94fb6068.png)
Calcula el orden de reacción y la constante de velocidad.
-
Periodo de semirreacción para la conversión del ciclopropano en propeno (562)
La conversión del ciclopropano en propeno en fase gaseosa responde a una cinética de primer orden con una constante de velocidad de 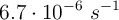 a una temperatura de
a una temperatura de 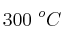 . Calcula el período de semirreacción.
. Calcula el período de semirreacción.
-
PAU: calor necesario para descomponer una mezcla que contiene carbonato de calcio (561)
Una mezcla de 5.00 g de carbonato de calcio e hidrogenocarbonato de calcio se calienta hasta la descomposición de ambos compuestos, obteniéndose 0.44 g de agua. Si las ecuaciones de descomposición son:
![\left \ce{CaCO3(s) ->[Q] CaO(s) + CO2(g)} \atop \ce{Ca(HCO3)2(s) ->[Q] CaO(s) + 2CO2(g) + H2O(g)} \left \ce{CaCO3(s) ->[Q] CaO(s) + CO2(g)} \atop \ce{Ca(HCO3)2(s) ->[Q] CaO(s) + 2CO2(g) + H2O(g)}](local/cache-TeX/0970104a9f031983598ac220a739bf3b.png)
a) Indica cuál es la composición de la mezcla en porcentaje en masa.
b) Calcula el calor que se tiene que suministrar para descomponer 10 g de carbonato de calcio.
Datos en (kJ/mol): ![\Delta H^0_f[\ce{CaCO3(s)}] = -1206 \Delta H^0_f[\ce{CaCO3(s)}] = -1206](local/cache-TeX/af08f25600aa45da531e1fc29d084922.png) ;
; ![\Delta H^0_f[\ce{CaO(s)}] = -635 \Delta H^0_f[\ce{CaO(s)}] = -635](local/cache-TeX/cf32a9e18b8e3af33695b60fa77c9611.png) ;
; ![\Delta H^0_f[\ce{CO2(g)}] = -393 \Delta H^0_f[\ce{CO2(g)}] = -393](local/cache-TeX/1fcc3ca04a5e08ba780c818bf2799483.png)
-
PAU espontaneidad 0001
Dadas las ecuaciones termoquímicas:
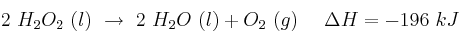
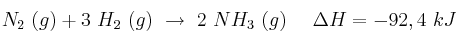
a) Define el concepto de entropía y explica el signo más probable para la variación de entropía en cada proceso.
b) Discute la espontaneidad de los procesos.
 RESUELTO
RESUELTO