-
Cinética química: formas de aumentar la velocidad de la reacción entre el mármol y un ácido (1261)
El mármol puede reaccionar con el ácido acético según la reacción:
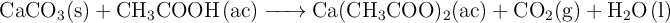
Sabiendo que se trata de una reacción débilmente exotérmica, explica dos maneras de aumentar la velocidad de reacción del proceso.
-
Cuestión cinética química 0009
En presencia de 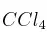 , el
, el 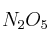 se disocia en oxígeno y dióxido de nitrógeno. Si la cinética de este proceso es de orden uno y su constante de velocidad, a 30 ºC, es
se disocia en oxígeno y dióxido de nitrógeno. Si la cinética de este proceso es de orden uno y su constante de velocidad, a 30 ºC, es 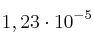 :
:
a) ¿Cuáles son las unidades de k?
b) ¿Cuál será el valor de v a 30 ºC si la concentración inicial de reactivo es 0,5 M?
c) Si la reacción fuese a 50 ºC, ¿aumentaría la velocidad de reacción?
d) Si la concentración inicial del reactivo fuese 0,001 M, ¿cuál sería la velocidad del proceso?
-
Cuestión cinética química 0008
Las energías de activación para tres reacciones distintas son: 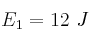 ;
; 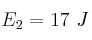 y
y 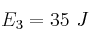 . Indica cuál de las tres reacciones es la más rápida y razona qué efecto tendrá en cada una de ellas un aumento de la temperatura.
. Indica cuál de las tres reacciones es la más rápida y razona qué efecto tendrá en cada una de ellas un aumento de la temperatura.
-
Cuestión cinética química 0007
La velocidad de reacción del proceso 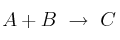 sigue la ecuación:
sigue la ecuación:
![v = k\ [A]^2[B] v = k\ [A]^2[B]](local/cache-TeX/13aec6ce51ed0e664884a61f239e742e.png)
A partir de estos datos responde a las siguientes cuestiones:
a) Indica el orden parcial de cada reactivo y el orden total de la reacción.
b) ¿Es un proceso bimolecular?
c) Si aumentamos la temperatura del sistema, ¿afectaría a esta reacción?
d) Si duplicamos la concentración inicial de A, ¿cómo variará la velocidad del proceso? ¿Y si triplicamos la concentración inicial de B?
-
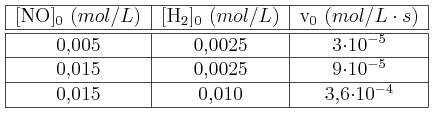
PAU cinética química 0009
En la reacción 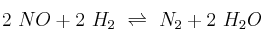 , a 1100 K, se obtuvieron los siguientes datos:
, a 1100 K, se obtuvieron los siguientes datos:
Velocidad reacción
Calcula el orden de reacción y el valor de la constante de velocidad.
 Velocidad reacción
Velocidad reacción