-
PAU cinética química 0008
Mediante un diagrama de energía-coordenada de la reacción, justifica si la velocidad de reacción depende de la diferencia de energía entre:
a) Reactivos y productos, en cualquier estado de agregación.
b) Reactivos y productos, en su estado estándar.
c) Reactivos y estado de transición.
d) Productos y estado de transición.
-
PAU cinética química 0007
En la reacción 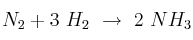 , el nitrógeno está reaccionando con una velocidad de 0,4 moles/minuto.
, el nitrógeno está reaccionando con una velocidad de 0,4 moles/minuto.
a) ¿A qué velocidad está reaccionando el hidrógeno? ¿Con qué velocidad se está formando el amoniaco?
b) ¿Con esos valores sería posible proponer valores adecuados para los exponentes 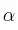 y
y 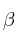 de la ecuación
de la ecuación ![v = k\ [N_2]^{\alpha}[H_2]^{\beta} v = k\ [N_2]^{\alpha}[H_2]^{\beta}](local/cache-TeX/fa2bc674a1ae8a9108ca814eb6f03ee5.png) o se necesitan más datos?
o se necesitan más datos?
-
Cinética química: aspectos que varían al añadir un catalizador negativo (580)
A un proceso le añadimos un catalizador negativo. Razona si las siguientes afirmaciones son verdaderas o falsas:
a) La variación de energía del proceso es negativa.
b) El orden total de reacción disminuye.
c) La velocidad de reacción disminuye.
d) Se modifica el mecanismo de reacción.
-
PAU cinética química 0006
La reacción 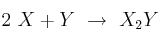 tiene órdenes parciales 2 y 1 respectivamente.
tiene órdenes parciales 2 y 1 respectivamente.
a) ¿Cuál es el orden total de reacción? Escribe la ecuación de velocidad del proceso.
b) ¿Qué relación existe entre la velocidad de desaparición de X y la de aparición de 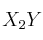 ?
?
c) ¿En qué unidades se puede expresar la velocidad de esta reacción? ¿Y la constante de velocidad?
d) ¿De qué factor depende el valor de la constante de velocidad de esta reacción?
-
PAU química: factores que afectan a la cinética de una reacción (576)
Para la reacción en fase gaseosa ideal  , cuya ecuación de velocidad es
, cuya ecuación de velocidad es ![v = k\ [A] v = k\ [A]](local/cache-TeX/82c512bb9639bf0675aa3a92ca7f594e.png) , indica cómo varía la velocidad de reacción:
, indica cómo varía la velocidad de reacción:
a) Al disminuir el volumen del sistema a la mitad.
b) Al variar las concentraciones de los productos sin modificar el volumen del sistema.
c) Al utilizar un catalizador.
d) Al aumentar la temperatura.
 Velocidad reacción
Velocidad reacción