-
Masa molecular aparente del aire 0001
El aire es un ejemplo de mezcla de dos gases. Sabrías calcular la masa molecular aparente de éste si en el aire la relación en volumen de los gases es de 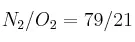 ?
?
Masas atómicas: O=16 ; N = 14
-
Reacciones: Composición centesimal y fórmula empírica 0001
La combustión de 25 g de un hidrocarburo dio 56,25 g de agua y 68,75 g de dióxido de carbono. Determina:
a) La composición centesimal de la muestra.
b) Su fórmula empírica.
c) El compuesto del que podría tratarse.
d) El número de moles de oxígeno necesarios para la combustión.
-
Porcentaje de un elemento en una molécula (2429)
Determina el porcentaje de hidrógeno en la molécula de agua.
-
Composición centesimal 0001
El sulfato de amonio, 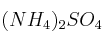 , se utiliza como fertilizante en agricultura. Calcula: a) el tanto por ciento en peso de nitrógeno en el compuesto; b) la cantidad de sulfato de amonio necesaria para aportar a la tierra 10 kg de nitrógeno.
, se utiliza como fertilizante en agricultura. Calcula: a) el tanto por ciento en peso de nitrógeno en el compuesto; b) la cantidad de sulfato de amonio necesaria para aportar a la tierra 10 kg de nitrógeno.
Masas atómicas: H = 1 ; N = 14 ; S = 32 ; O = 16
-
Fórmulas empírica y molecular 0001
Con relación a los compuestos benceno (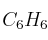 ) y acetileno (
) y acetileno (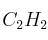 ), ¿cuáles de las siguientes afirmaciones son ciertas? Razone las respuestas.
), ¿cuáles de las siguientes afirmaciones son ciertas? Razone las respuestas.
a) Los dos tienen la misma fórmula empírica.
b) Los dos tienen la misma fórmula molecular.
c) Los dos tienen la misma composición centesimal.
 Composición centesimal
Composición centesimal