-
Reacción entre cinc y ácido clorhídrico (3327)
Cuando se introducen granallas de cinc en una disolución de ácido clorhídrico se observa que las primeras se transforman y se desprende hidrógeno, según la ecuación:

a) Calcula los moles de hidrógeno obtenidos si se ponen a reaccionar 100 gramos de ácido clorhídrico.
b) La masa de cinc necesaria para producir 1.25 moles de cloruro de cinc.
-
Estequiometría y presión parcial de un producto (3282)
Una muestra de 1.65 g de Al reacciona con HCl en exceso y el 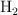 liberado se recoge sobre agua a
liberado se recoge sobre agua a  y a una presión barométrica de 744 mm Hg. ¿Cuál es el volumen total de
y a una presión barométrica de 744 mm Hg. ¿Cuál es el volumen total de 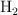 que se recoge, expresado en litros?
que se recoge, expresado en litros?
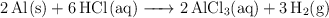
Dato: 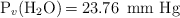 a
a 
-
Estequiometría y mol: descomposición de amoniaco (3276)
El amoniaco se descompone en nitrógeno e hidrógeno, ambos en estado gaseoso:
a) Escribe la ecuación de la reacción ajustada.
b ) Calcula la cantidad de hidrógeno que se desprende en la descomposición de 53 g de amoniaco.
c) ¿Cuántas moléculas de nitrógeno se desprenden?
-
Masa y moles de sustancia en una reacción química 0001
A partir de la ecuación ajustada 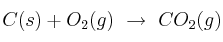 : calcula los moles y la masa de
: calcula los moles y la masa de 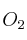 necesarios para reaccionar con 10 g de carbono.
necesarios para reaccionar con 10 g de carbono.
-
Reacciones y estequiometría: fotosíntesis (3229)
La fotosíntesis se puede resumir como:
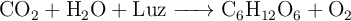
a) ¿Qué masa de glucosa se obtendrá si reaccionan 120 g de dióxido de carbono?
b) ¿Qué volumen de oxígeno se liberará, medido a 1 atm y 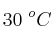 ?
?
c) ¿Qué cantidad de agua es necesaria para esa reacción?
 Mol
Mol