-
Isótopos: calculo de masa atómica (1645)
El estroncio, tal como existe en estado natural, está compuesto de cuatro isótopos que se enumeran a continuación con sus abundancias relativas expresadas en porcentajes de átomos. A partir de estos datos, calcula el peso atómico del estroncio en estado natural.
Isótopos: 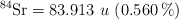 ;
; 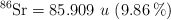 ;
; 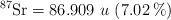 ;
; 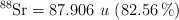
-
Verdadero o falso sobre el bloque de materia (499)
Razona si son verdaderas o falsas las siguientes afirmaciones:
a) Las sustancias puras son aquellas que están formadas por un tipo de átomo de los que están en la tabla periódica.
b) Ernest Rutherford estuvo trabajando con el tubo de rayos catódicos y dedujo la masa y la carga del electrón.
c) La masa atómica decimal de ciertos elementos se debe a que, al sumar la masa de los electrones, se obtienen valores decimales.
d) La molécula 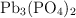 contiene un total de trece átomos.
contiene un total de trece átomos.
-
Masa atómica del azufre a partir de tres de sus isótopos (495)
Sabemos que los isótopos más estables del azufre son el 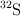 , el
, el 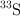 y el
y el 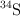 , cuyas abundancias relativas son
, cuyas abundancias relativas son 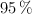 ,
, 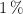 y
y 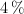 respectivamente. Determina la masa atómica del azufre.
respectivamente. Determina la masa atómica del azufre.
-
Verdadero o falso sobre isótopos (374)
Razona si son verdaderas o falsas las siguientes afirmaciones:
a) Los iones de los isótopos 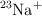 y
y 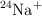 tienen el mismo comportamiento químico.
tienen el mismo comportamiento químico.
b) El ion 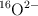 presenta la misma reactividad que el ion
presenta la misma reactividad que el ion 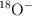 .
.
c) La masa atómica aproximada del cloro es 35.5 u, siendo este un valor promedio ponderado entre las masas de los isótopos 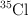 y
y 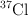 de abundancias relativas
de abundancias relativas 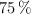 y
y 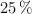 , respectivamente.
, respectivamente.
d) Los isótopos 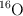 y
y 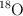 se diferencian en el número de electrones que poseen.
se diferencian en el número de electrones que poseen.
-
Masa atómica del silicio a partir de sus isótopos naturales (347)
El silicio presenta tres isótopos estables en la naturaleza. Sus masas isotópicas y sus abundancias relativas son:
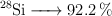
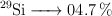
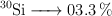
Calcula su masa atómica.
 Isótopos
Isótopos