-
Enlace químico y propiedades físicas (1797)
Dados los siguientes compuestos: 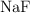 ,
, 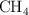 ,
, 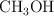 :
:
a) Indica el tipo de enlace.
b) Ordena de mayor a menor según su punto de ebullición. Razona tu respuesta.
c) Justifica la solubilidad o no en agua.
-
Reacción redox: ajuste y estequiometría 0003
En disolución acuosa y en medio ácido sulfúrico, el sulfato de hierro(II) reacciona con permanganato de potasio para dar sulfato de manganeso(II), sulfato de hierro(III) y sulfato de potasio.
a) Escribe y ajusta las correspondientes reacciones iónicas y la molecular del proceso por el método del ion-electrón.
b) Calcula la concentración molar de una disolución de sulfato de hierro(II) si 10 mL de esta disolución han consumido 22,3 mL de una disolución acuosa de permanganato de potasio 0,02 M.
-
Disoluciones: molaridad y fracción molar 0001
En una botella de ácido clorhídrico concentrado figuran los siguientes datos: 36 en masa, densidad 1,18 g/mL. Calcula:
en masa, densidad 1,18 g/mL. Calcula:
a) La molaridad de la disolución y la fracción molar del ácido.
b) El volumen de este ácido concentrado que se necesita para preparar un litro de disolución 2 M.
Masas atómicas: Cl = 35,5 ; H = 1 ; O = 16.
-
Cuestión ácido-base 0028
Razona si son verdaderas o falsas las siguientes afirmaciones:
a) Dos disoluciones acuosas de pH = 2 de distintos ácidos tienen la misma concentración de ácido.
b) Una base débil es aquella cuyas disoluciones acuosas siempre son diluidas.
c) La disociación de un ácido fuerte en agua es prácticamente total.
-
Estructura de Lewis, geometría molecular e hibridación 0001
Dadas las moléculas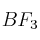 ,
, 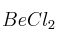 y
y 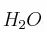 :
:
a) Escribe las estructuras de Lewis de las mismas.
b) Explique su geometría mediante la Teoría de Repulsión de los Pares de Electrones de la Capa de Valencia.
c) Indique la hibridación del átomo central.
 EBAU
EBAU