En la reacción de hierro metálico con vapor de agua se produce óxido ferroso- férrico (![]() ) e hidrógeno molecular.
) e hidrógeno molecular.
a) Formula y ajusta la reacción química que tiene lugar.
b) Calcula el volumen de hidrógeno gaseoso medido a ![]() y 5 atm que se obtiene por reacción de 558 g de hierro metálico.
y 5 atm que se obtiene por reacción de 558 g de hierro metálico.
c) ¿Cuántos gramos de óxido ferroso-férrico se obtendrán a partir de 3 moles de hierro?
d) ¿Cuántos litros de vapor de agua a 10 atm y ![]() se precisan para reaccionar con los 3 moles de hierro?
se precisan para reaccionar con los 3 moles de hierro?
Datos: Fe = 55.8 ; O = 16 ; ![]()
Si usamos 50 g de potasio y 45 g de oxígeno para reaccionar y formar óxido de potasio:
a) ¿Cuánto producto se forma?
b) ¿Qué reactivo sobra y en qué cantidad?
c) ¿Qué masa del otro reactivo sería necesaria para que reaccionara la totalidad de los reactivos?
Masas atómicas: K = 39 ; O = 16
Por 1 litro de disolución 3 M de NaOH se hace pasar ![]() a
a ![]() y 2 atm. Calcula:
y 2 atm. Calcula:
a) El volumen de ![]() que ha reaccionado.
que ha reaccionado.
b) El volumen de ![]() necesario, en condiciones normales.
necesario, en condiciones normales.
En la fotosíntesis, el ![]() de la atmósfera se convierte en
de la atmósfera se convierte en ![]() según la reacción:
según la reacción:
![]()
a) Ajusta la reacción
b) ¿Cuántos gramos de
El potasio y el oxígeno reaccionan para dar lugar al óxido de potasio.
a) Escribe y ajusta la reacción.
b) Calcula la masa de óxido de potasio que se obtendrá si hacemos reaccionar 45 g de potasio con exceso de oxígeno.
c) Calcula el volumen de oxígeno necesario, a 1 atm y 27 ºC, para obtener 32 g de óxido de potasio.
d) ¿Qué tipo de reacción es la que se produce?
Datos: K = 39 ; O = 16 ; 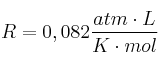
El sodio y el oxígeno reaccionan para dar lugar al óxido de sodio.
a) Escribe y ajusta la reacción.
b) Calcula la masa de sodio necesaria para obtener 75 g de óxido de sodio.
c) Calcula el volumen de oxígeno necesario, a 1,3 atm y 25 ºC, para obtener 48 g de óxido de sodio.
d) ¿Qué tipo de reacción es la que se produce?
Datos: Na = 23 ; O = 16 ; 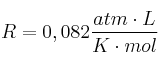
Los antiácidos son productos que combaten la acidez estomacal. La mayoría de estos antiácidos siguen la reacción del bicarbonato de sodio (![]() ) con el ácido cítrico (
) con el ácido cítrico (![]() ), para dar citrato de sodio (
), para dar citrato de sodio (![]() ), dióxido de carbono y agua.
), dióxido de carbono y agua.
a) Escribe y ajusta la reacción química.
b) Calcula la masa de ácido cítrico que debe utilizarse para que reaccionen 100 mg de bicarbonato de sodio.
c) Calcula la masa de ![]() liberado en la reacción anterior.
liberado en la reacción anterior.
d) Calcula el volumen que ocupa dicho ![]() , medido a 1.45 atm y
, medido a 1.45 atm y ![]() .
.
Disponemos, en un matraz, de 60 g de HCl a los que añadimos 30 g de
![]() , produciéndose la siguiente reacción:
, produciéndose la siguiente reacción:
![]()
a) Ajusta la reacción.
b) ¿Qué reactivo se encuentra en exceso?
c) ¿Cuántos gramos de dicho reactivo permanecerán sin reaccionar al final del proceso?
d) ¿Cuántos gramos de ![]() se producirán?
se producirán?
Masas atómicas: H = 1 ; Cl = 35,5 ; Mg = 24,3 ; O = 16
¿Cuáles son las sustancias que se producen en la descomposición del peróxido de hidrógeno? Escribe la ecuación química del proceso.
Escribe las reacciones de disociación de los siguientes compuestos: a) ácido nítrico; b) hidróxido de cinc; c) ácido perbrómico; d) hidróxido de cobre(II); e) ácido antimonioso.
 Ejercicios FyQ
Ejercicios FyQ