Para la siguiente reacción química en equilibrio:
![]()
Calcula los valores de las concentraciones de cada sustancia, si se tiene inicialmente 0.5 moles de ![]() en 2.3 litros de disolución y la constante
en 2.3 litros de disolución y la constante ![]() .
.
En un recipiente de 10 L se introducen 1 mol de nitrógeno y 2 mol de hidrógeno, ambos en estado gaseoso, que se calientan hasta 618 K. Una vez que se alcanza el equilibrio, se obtiene una mezcla que ejerce una presión total de 9.48 atm según la reacción:
![]()
Calcula:
a) Las concentraciones de ![]() ,
, ![]() y
y ![]() en el equilibrio.
en el equilibrio.
b) La ![]() .
.
c) La ![]() .
.
![]()
Se colocan en un recipiente de 2 litros, 4 moles de ![]() y 3 moles de
y 3 moles de ![]() . Si al alcanzar el equilibrio se encuentran 2 moles de
. Si al alcanzar el equilibrio se encuentran 2 moles de ![]() , calcula la constante de equilibrio para la reacción.
, calcula la constante de equilibrio para la reacción.
La constante de equilibrio ![]() de la reacción:
de la reacción:
![]()
a ![]() es 4.2. Determina la constante de equilibrio
es 4.2. Determina la constante de equilibrio ![]() de la reacción:
de la reacción:
![]()
Razona tu respuesta, escribiendo la expresión de las constantes de equilibrio en cada caso.
La descomposición del carbonato cálcico es un proceso endotérmico, en condiciones estándar, en el que se obtienen óxido de calcio y dióxido de carbono. Responde razonadamente a las siguientes cuestiones:
– a) ¿Variará la constante de equilibrio si retiramos parte del óxido de calcio obtenido?
– b) ¿Coincidirán los valores de ![]() y
y ![]() en esas condiciones?
en esas condiciones?
– c) ¿Cómo evoluciona el equilibrio si se disminuye la presión del sistema? ¿Y si se aumenta la temperatura?
En un matraz de 20 L, a 25 ºC, se encuentran en equilibrio 2,14 moles de ![]() y 0,50 moles de
y 0,50 moles de ![]() según:
según: ![]()
a) Calcule el valor de las constantes ![]() y
y ![]() a esa temperatura.
a esa temperatura.
b) ¿Cuál es la concentración de ![]() cuando se restablece el equilibrio después de introducir dos moles adicionales de
cuando se restablece el equilibrio después de introducir dos moles adicionales de ![]() , a la misma temperatura?
, a la misma temperatura?
Dato: R = 0,082 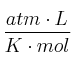
El fosgeno, ![]() , usado en la preparación de poliuretano, se obtiene a partir del
, usado en la preparación de poliuretano, se obtiene a partir del ![]() según la reacción:
según la reacción:
![]()
Una mezcla en equilibrio a ![]() contiene 0.01 moles de
contiene 0.01 moles de ![]() y 0.02 moles de
y 0.02 moles de ![]() por litro, así como cierta cantidad de
por litro, así como cierta cantidad de ![]() .
.
a) Si la ![]() de formación del fosgeno, a esa temperatura, vale
de formación del fosgeno, a esa temperatura, vale ![]() , ¿cuál es la concentración de
, ¿cuál es la concentración de ![]() ?
?
b) Calcula el valor de ![]() de la reacción anterior a esa temperatura.
de la reacción anterior a esa temperatura.
c) ¿Cuánto valdrá la constante ![]() de la descomposición del fosgeno a esa temperatura?
de la descomposición del fosgeno a esa temperatura?
En un reactor de 5 L se introducen inicialmente 0.8 moles de ![]() y 0.8 moles de
y 0.8 moles de ![]() . A
. A ![]() se establece el equilibrio:
se establece el equilibrio:
![]()
siendo la concentración de ![]() de 0.025 mol/L. Calcula:
de 0.025 mol/L. Calcula:
a) La concentración molar de todas las especies en el equilibrio.
b) ![]() y
y ![]() a dicha temperatura.
a dicha temperatura.
Basándote en las reacciones químicas correspondientes:
a) Calcula la solubilidad en agua del ![]() en mg/L.
en mg/L.
b) Justifica si precipitará ![]() al mezclar 50 mL de
al mezclar 50 mL de ![]() 0.01 M con 200 mL de
0.01 M con 200 mL de ![]() 0.05 M.
0.05 M.
Datos: ![]() . Masas atómicas relativas: C = 12 ; O = 16 ; Zn = 65.4.
. Masas atómicas relativas: C = 12 ; O = 16 ; Zn = 65.4.
 Ejercicios FyQ
Ejercicios FyQ