Un botella contiene 2,5 g de ![]() :
:
a) ¿Cuántos moles de ![]() contiene?
contiene?
b) ¿Cuántos átomos de oxígeno?
c) ¿Cuántos moles de carbono?
Si encerramos dos moles de un gas en un recipiente de 2,5 L a 20 ºC, ¿qué presión soportará el recipiente?
(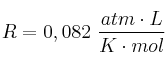 )
)
La masa molecular de una sustancia es 56 u y en su composición hay dos átomos de elementos distintos. Sabiendo que uno de ellos es oxígeno, ¿cuál es el otro elemento? ¿Qué cantidad de esa sustancia son 0,15 moles?
Introducimos 5,5 g de oxígeno gaseoso y 12 g de agua vapor en un recipiente de 3 L, a 20 ºC:
a) ¿Cuántos moles de gas hay en el recipiente?
b) ¿Cuántas moléculas de agua?
c) ¿Cuántos átomos de oxígeno?
d) ¿Qué presión ejercen los gases sobre las paredes del recipiente?
Datos: O = 16 ; H = 1 ; 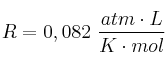
¿Cómo será la afinidad electrónica en átomos de radio pequeño?
Determina los litros de agua que se encuentran en 3.7 moles de la misma. Considera que la densidad del agua es 1 g/mL.
Masas atómicas: H = 1 ; O = 16.
Calcula el volumen molar de un gas que se encuentra a ![]() de temperatura y 8 atm de presión.
de temperatura y 8 atm de presión.
Calcula el volumen que ocupan 8 g de helio gaseoso en condiciones normales. (Masa atómica del He = 2)
Calcula el volumen que ocuparán ![]() moléculas de
moléculas de ![]() gaseoso, en condiciones normales.
gaseoso, en condiciones normales.
¿Cuál es el volumen, expresado en mL, que ocupa un gas ideal si 0.937 moles se encuentran a una temperatura de ![]() y a una presión de 3 709 mm Hg?
y a una presión de 3 709 mm Hg?
Dato: ![]()
 Ejercicios FyQ
Ejercicios FyQ