a) El calor de sublimación para una forma hipotética del agua en la que no hay puentes de hidrógeno es de 2.6 kcal/mol. Si el calor de sublimación observado en el agua es de 12.2 kcal/mol, ¿cuál es la energía de un enlace de hidrógeno?
b) El calor de fusión del hielo es 1.4 kcal/mol y el de la forma hipotética en la que no se forman puentes de hidrógeno es de 0.30 kcal/mol. Calcula el porcentaje de puentes de hidrógeno que se rompen. Recuerda que cada molécula de agua puede formar dos puentes de hidrógeno.
Para la reacción de formación de agua, a 298 K y 1 atm, según la ecuación: 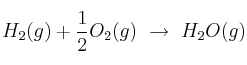 ;
; ![]() ;
; ![]() . Calcula:
. Calcula:
a) El valor de la variación de energía libre en estas condiciones.
b) La temperatura a la que el sistema no evoluciona por encontrarse en equilibrio, suponiendo que la entalpía y la entropía no varían con la temperatura.
La entalpía de reacción estándar de la reacción entre el metano y el dicloro para dar clorometano y cloruro de hidrógeno es ![]() . Sabiendo que la variación de entropía estándar es
. Sabiendo que la variación de entropía estándar es ![]() , calcula la variación de la energía libre de Gibbs estándar, a
, calcula la variación de la energía libre de Gibbs estándar, a ![]() , y decide si el proceso el espontáneo o no en estas condiciones.
, y decide si el proceso el espontáneo o no en estas condiciones.
El alcohol isopropílico, ![]() , tiene una masa molar de
, tiene una masa molar de ![]() . Un limpiador con base de este compuesto se usa para limpiar cristales o desinfectar superficies, evaporándose muy rápido sin dejar residuos. ¿Cuánta energía, expresada en kJ, se requiere para evaporar 12.5 mL del alcohol si su entalpía de vaporización, a temperatura estándar, es
. Un limpiador con base de este compuesto se usa para limpiar cristales o desinfectar superficies, evaporándose muy rápido sin dejar residuos. ¿Cuánta energía, expresada en kJ, se requiere para evaporar 12.5 mL del alcohol si su entalpía de vaporización, a temperatura estándar, es ![]() ?
?
La densidad del alcohol isopropílico es ![]() .
.
El contenido en glucosa de una manzana es un ![]() . Si la entalpía de combustión de la glucosa
. Si la entalpía de combustión de la glucosa ![]() , es
, es ![]() , calcula las calorías que aporta al cuerpo humano la ingesta de una manzana de 140 g. Ten en cuenta que una caloría dietética equivale a una kcal).
, calcula las calorías que aporta al cuerpo humano la ingesta de una manzana de 140 g. Ten en cuenta que una caloría dietética equivale a una kcal).
En condiciones estándar, el incremento de entalpía que se produce en la combustión de la glucosa (![]() ), es -2 800 kJ/mol. Determina qué energía se desprende cuando se queman 2.5 g de glucosa a volumen constante.
), es -2 800 kJ/mol. Determina qué energía se desprende cuando se queman 2.5 g de glucosa a volumen constante.
Cuando se queman 12 g de benceno a volumen constante en un calorímetro adiabático, los 4 kg de agua que bañan al reactor aumentan su temperatura ![]() . Determina la entalpía de combustión del benceno en condiciones estándar.
. Determina la entalpía de combustión del benceno en condiciones estándar.
Datos: ![]()
El motor de una máquina cortacésped funciona con una gasolina de composición única de octano (![]() ). Calcula:
). Calcula:
a) La entalpía de combustión estándar del octano aplicando la ley de Hess.
b) El calor que se desprende en la combustión de 2 kg de octano.
Masas atómicas: C = 12 u ; O = 16 u ; H = 1 u. Las entalpías estándar de formación del ![]() , del
, del ![]() y del
y del ![]() son respectivamente:
son respectivamente: ![]() ;
; ![]() y
y ![]() .
.
Calcula:
a) La entalpía de combustión estándar del octano líquido, sabiendo que se forman ![]() y
y ![]() gaseosos como productos.
gaseosos como productos.
b) La energía que necesita un automóvil por cada kilómetro si consume 5 L de octano por cada 100 km recorridos.
Datos: ![]() ;
; ![]() ;
; ![]() . Densidad del octano líquido
. Densidad del octano líquido ![]() . Masas atómicas: C =12 ; H = 1.
. Masas atómicas: C =12 ; H = 1.
Cuando reaccionan, en condiciones estándar, 6 g de carbono con hidrógeno gaseoso para formar metano se desprenden 37.452 kJ. Determina la entalpía de formación del metano.
 Ejercicios FyQ
Ejercicios FyQ