Calcula la normalidad de una disolución formada por 15 g de cada una de las siguientes sustancias en 100 mL de agua: a) ![]() ; b) KOH
; b) KOH
Se preparó una disolución 0,3 M de ![]() . Calcula su normalidad y su concentración en sulfatos expresada en mg/mL.
. Calcula su normalidad y su concentración en sulfatos expresada en mg/mL.
Calcula el volumen de oxígeno necesario para que reaccione totalmente con 2 kg de propano, si la reacción tiene lugar a una temperatura de ![]() y a una presión de 1.03 atm.
y a una presión de 1.03 atm.
Una disolución de 2.04 g de hemoglobina en 100 mL de disolución tiene una presión osmótica igual a 5.83 mm Hg, a ![]() . ¿Cuál es la masa molecular de la hemoglobina?
. ¿Cuál es la masa molecular de la hemoglobina?
El cinc es atacado por el ácido clorhídrico y su reacción desprende hidrógeno. Si una muestra de 15 g se hace reaccionar con ácido en exceso y libera 3,44 L de hidrógeno medidos a 27 ºC y 1 atm:
a) ¿Cuál es la riqueza de la muestra?
b) ¿Qué volumen de ácido 0,3 M haría falta para tratar 1,5 g de muestra?
Datos: Zn = 65,4 u ; Cl = 35,5 u ; H = 1 u ; R = 0,082 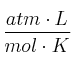
El bórax (![]() ) es un compuesto con múltiples usos que se disuelve muy fácilmente en agua. Si diluimos 50 mL de una disolución al
) es un compuesto con múltiples usos que se disuelve muy fácilmente en agua. Si diluimos 50 mL de una disolución al ![]() de bórax (
de bórax (![]() ) hasta los 150 mL con agua destilada:
) hasta los 150 mL con agua destilada:
a) ¿Cuál es la molaridad de la disolución final?
b) ¿Cuántos moles de boro contiene?
c) ¿Cuántos átomos de sodio habrá?
Datos: Na = 23 ; B = 10.8 ; O = 16 ; H = 1
En la final de waterpolo de unos Juegos Olímpicos se entregaron a los integrantes del equipo ganador unas medallas de oro circulares de 50 mm de diámetro con una masa de 0.185 g. Teniendo en cuenta que la densidad es una propiedad de la materia que permite la identificación de sustancias puras, ¿las medallas eran de oro? Razona la respuesta teniendo en cuenta que la densidad del oro es de ![]() .
.
Industrialmente, el metanol se obtiene haciendo reaccionar monóxido de carbono e hidrógeno a elevadas presiones y temperaturas. Calcula la masa de metanol que se puede obtener a partir de los reactivos contenidos en un reactor de 50 L, a 100 atm de presión y ![]() , si el rendimiento de la reacción es del
, si el rendimiento de la reacción es del ![]() .
.
Dato: ![]()
Una mezcla que contiene igual número de gramos de carbono y azufre da, por combustión, una mezcla de ![]() y
y ![]() que ocupa 67,2 L, medidos en c.n. Calcula la masa de cada elemento en la mezcla original.
que ocupa 67,2 L, medidos en c.n. Calcula la masa de cada elemento en la mezcla original.
Se tiene una mezcla gaseosa formada por 1 litro de metano, 3 litros de etano y 15 litros de oxígeno. Una vez que los gases han reaccionado, calcula el volumen final de las sustancias existentes en el interior del recipiente si todos ellos están medidos en las mismas condiciones de presión y temperatura, (el agua que se forma se considera en estado gaseoso).
 Ejercicios FyQ
Ejercicios FyQ