Reacción de combustión: moles, gases y número de Avogadro 0001
La combustión del heptano ![]() se hace con exceso de oxígeno a
se hace con exceso de oxígeno a ![]() y presión atmosférica:
y presión atmosférica:
a) ¿Cuál será la masa de agua que se obtiene si se queman 65 L de heptano? A la temperatura indicada el hidrocarburo es líquido y su densidad es 0,684 kg/L.
b) ¿Qué volumen de dióxido de carbono se obtendrá, medido en las condiciones de la combustión?
c) ¿Cuántas moléculas de oxígeno serán las necesarias para hacer la combustión?
Datos: C = 12 ; H = 1 ; O = 16 ; 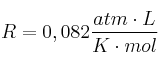 ;
; 
 Ejercicios FyQ
Ejercicios FyQ