-
Tipo de enlace entre hidrógeno y boro (851)
Razona el tipo de enlace que se dará entre el B y el H atendiendo a su estructura electrónica.
(Números atómicos: H = 1 ; B = 5)
-
Configuración electrónica, estados de oxidación y tipos de enlace (850)
Sabiendo que los números atómicos de A, B y C son 16, 17 y 20 respectivamente:
a) Escribe sus configuraciones electrónicas.
b) Deduce sus estados de oxidación más probables.
c) Razona el tipo de enlace que se establecerá entre la pareja B/C y entre la pareja A/B.
-
Cálculo de la masa y la densidad de la Tierra hecho por Cavendish (842)
Cavendish dedujo el valor de la constante G pero también fue capaz de calcular la masa y la densidad de la Tierra a partir de los datos cartográficos que se tenían del planeta. ¿Cómo lo hizo?
-
Descomposición térmica del clorato de potasio (840)
El clorato potásico se descompone térmicamente según la reacción:
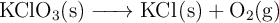
Si se calientan 15 g de 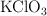 . Calcula:
. Calcula:
a) ¿Qué masa de KCl se obtendrá?
b) ¿Qué masa de oxígeno,  ?
?
c) ¿Qué volumen de oxígeno, medido en condiciones normales?
(Datos: K = 39 ; Cl = 35.5 ; O = 16)
-
Leyes ponderales: ley de Lavoisier y ley de Proust (838)
Calentamos una muestra de 2.5 g de estaño puro al aire hasta que se obtienen 3.17 g de producto. ¿Qué cantidad de oxígeno ha reaccionado con el estaño? Si hubiésemos calentado 6 g de estaño con solo 1 g de oxígeno, ¿cuánto producto se habría formado?
 RESUELTO
RESUELTO