-
Diferencia entre los calores a presión y a volumen constante (268)
La reacción entre 1 g de Zn y ácido sulfúrico en exceso desprende 2 405 J en un recipiente abierto y 2 443 J en un recipiente cerrado. Escribe la reacción ajustada y explica por qué se produce esa diferencia.
-
Ejercicio de cambio de unidades a unidades SI (267)
Convierte las siguientes magnitudes en unidades del S.I:
a) 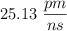
b) 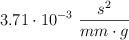
c) 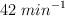
d) 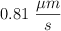
e) 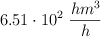
-
Entalpía de reacción a partir de las energía de enlace y las entalpías de formación (266)
Calcula la entalpía estándar de la reacción:
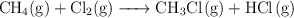
a partir de:
a) Las energías de enlace.
b) Las entalpías de formación.
Datos:
Energías de enlace (kJ/mol): C-H = 414 ; Cl-Cl = 244 ; C-Cl = 330 ; H-Cl = 430
Entalpías de Formación (kJ/mol): 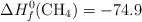 ;
; 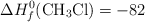 ;
; 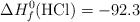
-
Problema ley de Hess (265)
Los calores de combustión del 1,3-butadieno (g), el hidrógeno (g) y el butano (g) son, respectivamente: -2540 ; -285,8 y -2880 kJ/mol. Con estos datos, calcula la variación de entalpía de reacción para el proceso:
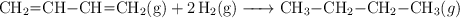
-
Ley de Hess: entalpía de formación del etino (264)
Calcula la entalpía de formación estándar del etino sabiendo que las entalpías de combustión del carbono(s), hidrógeno(g) y etino(g) son, respectivamente: -393.5, -285.8 y -1 300 kJ/mol.
 RESUELTO
RESUELTO