-
Constantes de equilibrio: Dependencia de la temperatura 0001
A 613 K, el valor de  para la reacción:
para la reacción: 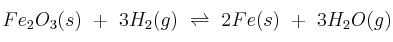 es 0,064. Si en el equilibrio anterior la presión parcial del hidrógeno es una atmósfera, calcula:
es 0,064. Si en el equilibrio anterior la presión parcial del hidrógeno es una atmósfera, calcula:
a) La concentración de hidrógeno.
b) La presión total.
-
Constante de equilibrio y Principio de Le Chatelier 0001
En un recipiente cerrado se establece el siguiente equilibrio:
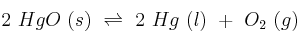 ;
; 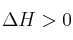
a) Escriba las expresiones de las constantes 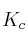 y
y 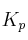 .
.
b) ¿Cómo afecta al equilibrio un aumento de la presión parcial de oxígeno?
c) ¿Qué le ocurrirá al equilibrio cuando se aumente la temperatura?
-
Equilibrio químico: Kp y presiones parciales 0001
Para la reacción: 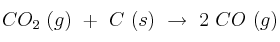 ,
,  = 10 a la temperatura de 815 ºC. Calcule, en el equilibrio:
= 10 a la temperatura de 815 ºC. Calcule, en el equilibrio:
a) Las presiones parciales de  y CO a esa temperatura, cuando la presión total en el reactor es de 2 atm.
y CO a esa temperatura, cuando la presión total en el reactor es de 2 atm.
b) El número de moles de  y de CO, si el volumen del reactor es de 3 litros.
y de CO, si el volumen del reactor es de 3 litros.
-
Equilibrio químico: Constantes de equilibrio Kc y Kp 0001
Una mezcla de 2,5 moles de nitrógeno y 2,5 moles de hidrógeno se coloca en un reactor de 25 L y se calienta a 400 ºC. En el equilibrio ha reaccionado el 5  del nitrógeno. Calcula:
del nitrógeno. Calcula:
a) Los valores de las constantes de equilibrio  y
y  a 400 ºC, para la reacción
a 400 ºC, para la reacción 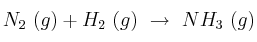
b) Las presiones parciales de los gases en el equilibrio.
-
PAU equilibrio químico 0012
A la temperatura de 400 ºC y 710 mm Hg de presión, el amoniaco se encuentra disociado en un 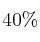 según la ecuación:
según la ecuación:
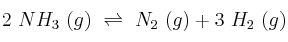
Calcula:
a) La presión parcial de cada uno de los gases que constituyen la mezcla en equilibrio.
b) El valor de las constantes  y
y  a esas temperaturas.
a esas temperaturas.
(Dato: 1 atm = 760 mm Hg)
 Presión parcial
Presión parcial