-
Reacciones: Composición centesimal y fórmula empírica 0001
La combustión de 25 g de un hidrocarburo dio 56,25 g de agua y 68,75 g de dióxido de carbono. Determina:
a) La composición centesimal de la muestra.
b) Su fórmula empírica.
c) El compuesto del que podría tratarse.
d) El número de moles de oxígeno necesarios para la combustión.
-
Átomos de un elemento en una masa determinada 0001
¿Cuántos átomos de Ne hay en 0,25 g de Ne?
-
Masa de una cantidad de moléculas de borano 0001
Una muestra contiene 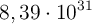 moléculas de borano. Determina la masa de esta muestra. Datos: H = 1 y B = 11
moléculas de borano. Determina la masa de esta muestra. Datos: H = 1 y B = 11
-
Moles presentes en una cantidad de sustancia 0001
Se pesan en el laboratorio 2564,45 mg de 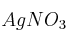 en balanza analítica, ¿cuántos moles de esa sustancia están presentes en la muestra?
en balanza analítica, ¿cuántos moles de esa sustancia están presentes en la muestra?
-
Incremento de masa en una sal hidratada 0001
Indica en cuánto aumenta la masa de 3,55 g de sulfato de sodio al convertirse completamente en sulfato de sodio decahidratado.
 Mol
Mol