-
Problema equilibrio químico 0008
En un recipiente de un litro, a 500 K, se introduce un mol de cloruro de nitrosilo (ClNO). Cuando se alcanza el equilibrio, el ClNO se encuentra disociado en un 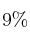 . Calcula, para la temperatura de 500 K, el valor de
. Calcula, para la temperatura de 500 K, el valor de  y
y  correspondiente al equilibrio:
correspondiente al equilibrio:
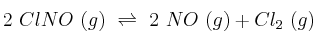
-
Problema equilibrio químico 0006
Para la reacción 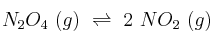 ,
,  es 0,14 atm a 25 ºC. Un matraz cerrado contiene una mezcla de estos gases en el equilibrio a dicha temperatura. Si la presión parcial de
es 0,14 atm a 25 ºC. Un matraz cerrado contiene una mezcla de estos gases en el equilibrio a dicha temperatura. Si la presión parcial de 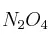 es 0,25 atm:
es 0,25 atm:
a) ¿Cuál es la presión parcial de 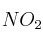 ?
?
b) ¿Cuál es la presión total de la mezcla?
-
Problema equilibrio químico 0005
En un recipiente de 10 L, a 800 K, se encierran un mol de CO (g) y un mol de vapor de agua. Cuando se alcanza el equilibrio:
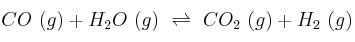
hay 0,665 moles de dióxido de carbono y 0,665 moles de hidrógeno gaseoso.
a) ¿Cuáles son las concentraciones de cada una de las especies en el equilibrio?
b) ¿Cuál es el valor de  para dicha reacción a 800 K?
para dicha reacción a 800 K?
-
Problema equilibrio químico 0004
En un matraz de 1 L hay 0,004 moles de 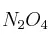 en equilibrio con 0,12 moles de
en equilibrio con 0,12 moles de 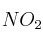 , a 373 K. Halla el valor de
, a 373 K. Halla el valor de  , a dicha temperatura, para el equilibrio:
, a dicha temperatura, para el equilibrio:
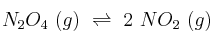
-
Problema equilibrio químico 0003
Se introducen, en un recipiente de 1,5 L, 0,300 moles de 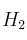 y 0,600 moles de
y 0,600 moles de 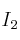 , a 350 ºC. Si la constante de equilibrio a esa temperatura es 38, ¿cuál es la concentración de cada especie en el equilibrio
, a 350 ºC. Si la constante de equilibrio a esa temperatura es 38, ¿cuál es la concentración de cada especie en el equilibrio 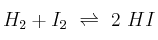 ?
?
 Constante equilibrio
Constante equilibrio