-
Preparación de una disolución molar a partir de sulfúrico comercial
El ácido sulfúrico (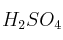 ) comercial es un líquido con densidad de 1,84 g/mL que está al
) comercial es un líquido con densidad de 1,84 g/mL que está al 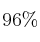 . Realiza los cálculos e indica el procedimiento para preparar 250 mL de una disolución 0,5 M. ¿Cuáles son los instrumentos de laboratorio adecuados para la preparación de la disolución?
. Realiza los cálculos e indica el procedimiento para preparar 250 mL de una disolución 0,5 M. ¿Cuáles son los instrumentos de laboratorio adecuados para la preparación de la disolución?
-
Volumen de ácido sulfúrico comercial que contiene 40 g de soluto
Calcula el volumen de ácido sulfúrico de densidad 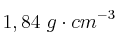 y riqueza del
y riqueza del 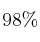 en peso necesario para disponer de 40 g de ácido sulfúrico puro. Calcula la molaridad de la disolución que se obtendrían si se disuelven en agua hasta tener un volumen de 200 mL.
en peso necesario para disponer de 40 g de ácido sulfúrico puro. Calcula la molaridad de la disolución que se obtendrían si se disuelven en agua hasta tener un volumen de 200 mL.
Datos: S = 32 ; O = 16 ; H = 1.
-
Preparar una disolución de acético 0.1 M a partir de disolución comercial (4836)
Las especificaciones de la etiqueta de un frasco de ácido acético comercial son las siguientes: densidad 1.2 g/mL, riqueza 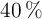 en peso. Calcula qué volumen de dicho ácido hay que tomar para preparar un litro de disolución 0.1 M.
en peso. Calcula qué volumen de dicho ácido hay que tomar para preparar un litro de disolución 0.1 M.
Datos: C = 12 ; O = 16 ; H = 1.
-
Molaridad y dilución de una solución de ácido permangánico
Tenemos una botella de ácido permangánico al 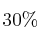 en peso y cuya densidad es de 1,3 g/mL. Si tomamos 200 mL de la botella:
en peso y cuya densidad es de 1,3 g/mL. Si tomamos 200 mL de la botella:
a) ¿Cuántos gramos de ácido permangánico habrá disueltos?
b) Su molaridad.
c) Si ahora, de los 200 mL que he tomado, separo 20 mL y los echo en un vaso con 70 mL de agua, ¿Cuál será la nueva concentración? ¿Estoy diluyendo o concentrando?
Datos: Mn = 55 ; H = 1 ; O = 16.
-
Moles, gramos y concentración de una disolución de sulfato de hierro(III) (4834)
Tengo 100 g de sulfato de hierro(III) en agua, siendo el volumen de disolución 500 mL. Calcula:
a) ¿Cuántos moles y cuántos equivalentes de sulfato de hierro(III) hay?
b) ¿Cuántas moléculas de la sal hay en la disolución?
c) ¿Cuántos moles de hierro, azufre y oxígeno hay en esa cantidad de sal?
d) ¿Cuántos gramos de hierro hay en esa cantidad de sal?
e) La normalidad y la molaridad de la disolución.
Datos: Fe = 56 ; S = 32 ; O = 16 ; 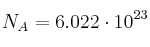 .
.
 Molaridad
Molaridad