-
Ajuste ion-electrón y estequiometría selectividad junio 2012
El dióxido de manganeso reacciona en medio de hidróxido de potasio con clorato de potasio para dar permanganato de potasio, cloruro de potasio y agua.
a) Ajusta la ecuación molecular por el método del ion-electrón.
b) Calcula la riqueza en dióxido de manganeso de una muestra si 1 g de la misma reacciona exactamente con 0,35 g de clorato de potasio
Datos: O = 16 ; K = 39 ; Mn = 55 ; Cl = 35,5
-
Procesos redox: Potenciales estándar de reducción 0001
Dados los valores de potencial de reducción estándar de los sistemas: 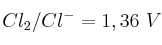 ;
; 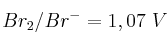 y
y 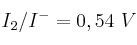 , indica razonadamente:
, indica razonadamente:
a) ¿Cuál es la especie química más oxidante entre las mencionadas anteriormente?
b) ¿Es espontánea la reacción entre el cloro molecular y el ion yoduro?
c) ¿Es espontánea la reacción entre el yodo y el ion bromuro?
-
Potenciales estándar de reducción 0001
Razona, escribiendo la reacción ajustada en cada caso:
a) Si el cobre metálico puede ser oxidado a cobre(1+) con una disolución de permanganato potásico.
b) Si el cobre metálico puede ser oxidado a cobre(2+) con una disolución de ácido sulfúrico.
Datos: 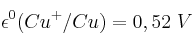 ;
; 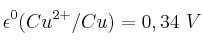 ;
; 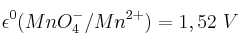 ;
; 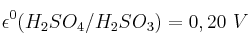
-
Electroquímica: aplicación de la ley de Faraday (1750)
En el cátodo de una cuba electrolítica se reduce la especie dicromato a catión 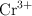 , en medio ácido. Calcula:
, en medio ácido. Calcula:
a) ¿Cuántos moles de electrones deben llegar al cátodo para reducir un mol de dicromato?
b) Para reducir toda la especie dicromato presente en 20 mL de disolución, se requiere una corriente eléctrica de 2.2 amperios durante 15 minutos. Calcula la carga que se consume, expresada en Faraday, y deduce cuál será la concentración inicial de dicromato.
Dato: F = 96 500 C.
-
Reacciones redox: Números de oxidación 0001
Para la reacción: 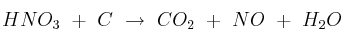 , justifica la veracidad o falsedad de las siguientes afirmaciones:
, justifica la veracidad o falsedad de las siguientes afirmaciones:
a) El número de oxidación del oxígeno pasa de -2 a 0.
b) El carbono se oxida a  .
.
c) El 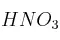 se reduce a NO.
se reduce a NO.
 Proceso redox
Proceso redox