-
Problema equilibrio químico 0016
En un recipiente de 3 L se introducen 0,60 moles de 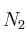 y 0,36 moles de
y 0,36 moles de 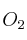 . Calentamos el recipiente hasta los 650 ºC y se establece el equilibrio:
. Calentamos el recipiente hasta los 650 ºC y se establece el equilibrio:
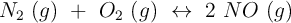
En estas condiciones reacciona el 5,3 del nitrógeno existente. Calcula el valor de
del nitrógeno existente. Calcula el valor de  a esa temperatura y la presión total en el recipiente cuando se ha alcanzado el equilibrio.
a esa temperatura y la presión total en el recipiente cuando se ha alcanzado el equilibrio.
-
pH de una disolución de ácido acético y grado de disociación (714)
En 500 mL de agua se disuelven 3 g de ácido acético. Calcula:
a) El pH de la disolución.
b) El porcentaje de ácido acético ionizado.
Datos: 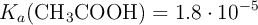 ; H = 1 ; O = 16 ; C = 12
; H = 1 ; O = 16 ; C = 12
-
PAU equilibrio químico 0012
A la temperatura de 400 ºC y 710 mm Hg de presión, el amoniaco se encuentra disociado en un 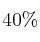 según la ecuación:
según la ecuación:
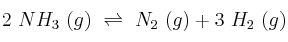
Calcula:
a) La presión parcial de cada uno de los gases que constituyen la mezcla en equilibrio.
b) El valor de las constantes  y
y  a esas temperaturas.
a esas temperaturas.
(Dato: 1 atm = 760 mm Hg)
-
PAU equilibrio químico 0009
El dióxido de nitrógeno, a temperatura alta, se disocia en monóxido de nitrógeno y oxígeno:
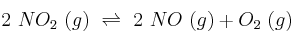
Un recipiente metálico de 2,0 L de capacidad contiene solamente dióxido de nitrógeno a 25 ºC y 21,1 atm de presión. Se calienta el recipiente hasta 300 ºC, manteniéndose constante el volumen, y se observa que la presión de equilibrio en el recipiente es de 50 atm. Calcula, a 300 ºC:
a) El grado de disociación del 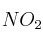 .
.
b) El valor de  para el equilibrio de disociación del
para el equilibrio de disociación del 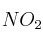 .
.
(Dato: 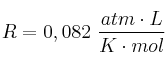 )
)
-
PAU equilibrio químico 0004
En un matraz de 2 L se introducen 12 g de pentacloruro de fósforo y se calienta hasta 300 ºC. Al establecerse el equilibrio de disociación a esta temperatura:
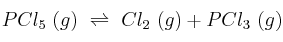
la presión total de la mezcla es 2,12 atm.
a) ¿Cuánto vale el grado de disociación en las condiciones señaladas?
b) ¿Cuál es el valor de  a esa temperatura?
a esa temperatura?
 Grado disociación
Grado disociación