-
Estequiometría de una reacción química 0001
Sobre una muestra de aluminio se vierten 20 mL de HCl al 10 en masa. Calcula la masa de
en masa. Calcula la masa de 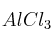 y el volumen de hidrógeno, medido a 25 ºC y 1 atm, que se obtendrán.
y el volumen de hidrógeno, medido a 25 ºC y 1 atm, que se obtendrán.
Dato: densidad de la disolución: 1,14 g/mL.
-
Reacción de sodio en agua 0001
Cuando se mezclan sodio metálico y agua se produce una reacción que desprende mucha energía, tanta que puede producirse una explosión. La reacción que tiene lugar es: 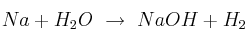
a) ¿Qué masa de NaOH se obtiene si se ponen 15 g de Na en un recipiente de agua?
b) ¿Qué masa de hidrógeno se desprenderá?
c) ¿Cuál será el volumen de 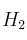 medido a 0,8 atm y 32 ºC?
medido a 0,8 atm y 32 ºC?
-
Estequiometría: volumen de producto 0001
La oxidación del óxido de azufre (IV) da como resultado óxido de azufre (VI). ¿Qué volumen de éste se obtendrá, medido a 1 atm y 27 ºC, cuando se oxiden 100 g de dióxido de azufre con exceso de oxígeno?
-
Reacciones sucesivas y estequiometría 0001
Al tratar ácido sulfúrico con carbonato de hierro(III) se obtiene un producto que, al reaccionar con hidróxido sódico, da lugar a un precipitado de hidróxido de hierro (III). Si la masa de este precipitado es de 444 g, ¿qué cantidad de carbonato de férrico habría reaccionado en la primera reacción?
-
Masa de producto y estequiometría 0001
Se hacen reaccionar 25 gramos de cinc con 28 gramos de ácido clorhídrico. Sabiendo que se forman 0,76 gramos de hidrógeno, ¿cuál es la cantidad de cloruro de cinc que se formará?
 Ajuste
Ajuste