-
Estequiometría: Gases y disoluciones 0001
Se dispone de una disolución acuosa de HCl, cuya densidad es de 1,03 g/mL. Se toman 5 mL de esta disolución a los que se les va añadiendo cinc en polvo hasta que se observa que cesa el desprendimiento de gas, momento en el que se para la reacción y se mide que se han desprendido 70 mL de gas, medidos en c.n.
a) Indica la naturaleza del gas que se desprende.
b) Halla los gramos de cinc que han reaccionado en el HCl.
c) Halla la concentración en  en peso de la disolución de HCl.
en peso de la disolución de HCl.
d) ¿Cuál es la molaridad y la molalidad de la disolución de HCl?
-
Volumen de ácido sulfúrico a partir de pirita con una pureza dada (1597)
La producción de ácido sulfúrico a partir de la pirita se realiza mediante la siguiente serie de reacciones: a) tueste del 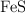 ; b) oxidación del
; b) oxidación del  ; c) hidratación del
; c) hidratación del 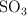 . ¿Qué volumen de
. ¿Qué volumen de 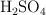 concentrado, del
concentrado, del 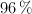 de riqueza y densidad 1.84 g/mL, puede obtenerse teóricamente a partir de 100 kg de pirita del
de riqueza y densidad 1.84 g/mL, puede obtenerse teóricamente a partir de 100 kg de pirita del 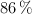 de pureza? Escribe y ajusta en cada apartado la reacción correspondiente.
de pureza? Escribe y ajusta en cada apartado la reacción correspondiente.
-
Reacciones químicas: riqueza de los reactivos (1592)
Para determinar la riqueza de una muestra de cinc se toman 50 g de la misma y se tratan con una disolución de ácido clorhídrico del 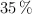 en peso de riqueza y densidad 1.18 g/mL, consumiéndose 129 mL. Calcula el porcentaje de cinc de la muestra y la molaridad de la disolución de ácido clorhídrico.
en peso de riqueza y densidad 1.18 g/mL, consumiéndose 129 mL. Calcula el porcentaje de cinc de la muestra y la molaridad de la disolución de ácido clorhídrico.
Masas atómicas 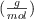 : Zn = 65.4 ; H = 1 ; Cl = 35.5
: Zn = 65.4 ; H = 1 ; Cl = 35.5
-
Reacciones químicas: estequiometría, disoluciones y gases 0001
El carbonato de magnesio reacciona con el trihidrógeno(tetraoxidofosfato) y da lugar al fosfato de magnesio, dióxido de carbono y agua.
a) Escribe la ecuación química.
b) Si se mezclan 22 g de carbonato de magnesio y 37 mL de ácido fosfórico (densidad = 1,34 g/mL y riqueza 50 en peso), ¿qué volumen de dióxido de carbono se obtiene, medido a 23 ºC y una presión de 743 mm Hg.
en peso), ¿qué volumen de dióxido de carbono se obtiene, medido a 23 ºC y una presión de 743 mm Hg.
-
Estequiometría y reactivo limitante 0001
El cloruro de sodio reacciona con nitrato de plata precipitando totalmente cloruro de plata y obteniéndose además nitrato de sodio. Calcule:
a) La masa de cloruro de plata que se obtiene a partir de 100 mL de disolución de nitrato de plata 0,5 M y de 100 mL de disolución de cloruro de sodio 0,4 M.
b) Los gramos del reactivo en exceso.
Masas atómicas: O = 16; Na = 23; N = 14; Cl = 35,5; Ag = 108.
 Disoluciones
Disoluciones