-
PAU Andalucía junio 2013: equilibrio químico y grado de disociación
A 350 K la constante de equilibrio  de la reacción de descomposición del bromuro de carbonilo vale 0,205:
de la reacción de descomposición del bromuro de carbonilo vale 0,205: 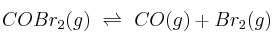 . Si en un recipiente de 3 L se introducen 3,75 mol de bromuro de carbonilo y se calienta hasta alcanzar esa temperatura:
. Si en un recipiente de 3 L se introducen 3,75 mol de bromuro de carbonilo y se calienta hasta alcanzar esa temperatura:
a) ¿Cuáles son las concentraciones de todas las especies en el equilibrio?
b) ¿Cuál es el grado de disociación del bromuro de carbonilo en esas condiciones?
-
Interpretación de la constante de equilibrio 0001
Con base al valor de  decide si se espera o no que la reacción sea casi completa en equilibrio para cada caso:
decide si se espera o no que la reacción sea casi completa en equilibrio para cada caso:
a) 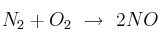 donde
donde 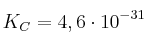
b) 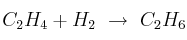 donde
donde 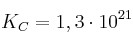
-
Producto de solubilidad, solubilidad y precipitados 0001
La solubilidad del hidróxido de hierro(II) en agua pura, a 298 K, es 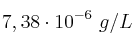 .
.
a) Calcula el producto de solubilidad del hidróxido de hierro (II).
b) Indica si el hidróxido precipitará cuando se adicionen 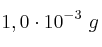 de cloruro de hierro(II) a 1,0 L de una disolución de hidróxido de sodio que contenga una concentración de
de cloruro de hierro(II) a 1,0 L de una disolución de hidróxido de sodio que contenga una concentración de ![[OH^-] = 1,0\cdot 10^{-8}\ M [OH^-] = 1,0\cdot 10^{-8}\ M](local/cache-TeX/8a86190968c5c557bed444cfadfa1d50.png) .
.
Datos: Fe = 56 ; Cl = 35,5 ; O = 16 ; H = 1
-
Equilibrio heterogéneo: formación de precipitados (1987)
Se disuelven 0.12 g de sulfato de aluminio en 1 L de agua y se toman 80 mL de esta disolución que son mezclados con 20 mL de una disolución de NaOH (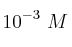 ). Determina si precipitará hidróxido de aluminio o no.
). Determina si precipitará hidróxido de aluminio o no.
Datos: Al = 27 ; S = 32 ; O = 16 ; 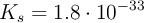 .
.
-
PAU Andalucía septiembre 2012: Equilibrio químico
En un recipiente que tiene una capacidad de 4 L, se introducen 5 moles de 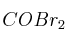 (g) y se calienta hasta una temperatura de 350 K. Si la constante de disociación del
(g) y se calienta hasta una temperatura de 350 K. Si la constante de disociación del 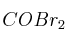 (g) para dar CO (g) y
(g) para dar CO (g) y 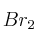 (g) es
(g) es  = 0,190. Determina:
= 0,190. Determina:
a) El grado de disociación y la concentración de las especies en equilibrio.
b) A continuación, a la misma temperatura, se añaden 4 moles de CO al sistema. Determina la nueva concentración de todas las especies una vez alcanzado el equilibrio.
 Concentraciones
Concentraciones