-
Producto de solubilidad, solubilidad y precipitados 0001
La solubilidad del hidróxido de hierro(II) en agua pura, a 298 K, es 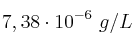 .
.
a) Calcula el producto de solubilidad del hidróxido de hierro (II).
b) Indica si el hidróxido precipitará cuando se adicionen 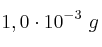 de cloruro de hierro(II) a 1,0 L de una disolución de hidróxido de sodio que contenga una concentración de
de cloruro de hierro(II) a 1,0 L de una disolución de hidróxido de sodio que contenga una concentración de ![[OH^-] = 1,0\cdot 10^{-8}\ M [OH^-] = 1,0\cdot 10^{-8}\ M](local/cache-TeX/8a86190968c5c557bed444cfadfa1d50.png) .
.
Datos: Fe = 56 ; Cl = 35,5 ; O = 16 ; H = 1
-
Equilibrio heterogéneo: formación de precipitados (1987)
Se disuelven 0.12 g de sulfato de aluminio en 1 L de agua y se toman 80 mL de esta disolución que son mezclados con 20 mL de una disolución de NaOH (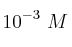 ). Determina si precipitará hidróxido de aluminio o no.
). Determina si precipitará hidróxido de aluminio o no.
Datos: Al = 27 ; S = 32 ; O = 16 ; 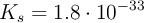 .
.
-
Selectividad septiembre 2012: solubilidad 0001
A 25ºC la constante del equilibrio de solubilidad del 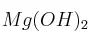 sólido es,
sólido es, 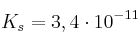 .
.
a) Establece la relación que existe entre la constante 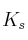 y la solubilidad (s) del
y la solubilidad (s) del 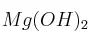 .
.
b) Explica, razonadamente, cómo se podría disolver, a 25 ºC y mediante procedimientos químicos, un precipitado de 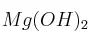 .
.
c) ¿Qué efecto tendría sobre la solubilidad del 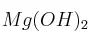 a 25 ºC la adición de cloruro de magnesio? Razona la respuesta.
a 25 ºC la adición de cloruro de magnesio? Razona la respuesta.
-
Ejercicio solubilidad selectividad junio 2012
En un vaso de agua se pone una cierta cantidad de una sal poco soluble, de fórmula general 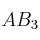 y no se disuelve completamente. El producto de solubilidad de la sal es
y no se disuelve completamente. El producto de solubilidad de la sal es 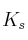 :
:
a) Deduce la expresión que relaciona la concentración molar de 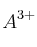 con el producto de solubilidad de la sal.
con el producto de solubilidad de la sal.
b) Si se añade una cantidad de sal muy soluble de 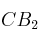 . Indica razonadamente la variación que se produce en la solubilidad de la sal
. Indica razonadamente la variación que se produce en la solubilidad de la sal 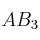 .
.
c) Si B es el ion 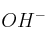 ¿Cómo influye la disminución del pH en la solubilidad del compuesto?
¿Cómo influye la disminución del pH en la solubilidad del compuesto?
-
Equilibrio sólido-líquido: Producto de solubilidad y solubilidad (1774)
A cierta temperatura el producto de solubilidad en agua del AgI es 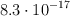 . Para esa temperatura, calcula la solubilidad molar del compuesto en:
. Para esa temperatura, calcula la solubilidad molar del compuesto en:
a) Una disolución 0.1 M de 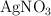 .
.
b) Una disolución de ácido yodhídrico de pH = 2
 Producto solubilidad
Producto solubilidad