-
Volumen de aire necesario para quemar un kg de madera en La Paz (5723)
Calcula los litros de aire, cuya fracción molar de oxígeno es del 0.2 y el resto es de nitrógeno, que serán necesarios para quemar completamente un trozo de madera de 1 kg, con una pureza en carbono del 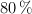 , en La Paz (a una presión de 493 mm Hg y
, en La Paz (a una presión de 493 mm Hg y 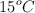 ). Considera que el
). Considera que el 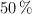 de la madera se quema completamente a
de la madera se quema completamente a 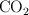 y el otro
y el otro 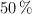 se quema solo hasta
se quema solo hasta 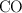 .
.
-
Porcentaje de hidrógeno en una mezcla inicial sabiendo el volumen que sobra tras la reacción (5573)
Una mezcla de 50 mL de hidrógeno y oxígeno es sometida a una descarga eléctrica para formar agua. El gas resultante, que es solo hidrógeno, tiene un volumen de 10 mL a la presión atmosférica. ¿Cuál era el porcentaje de hidrógeno en la mezcla inicial?
-
Relación volumétrica entre las especies que reaccionan en la formación del HCN (5571)
El cianuro de hidrógeno, un compuesto altamente venenoso, se prepara comercialmente mediante la siguiente reacción, realizada a alta temperatura y en presencia de catalizador:
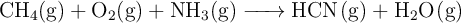
a) Escribe la ecuación química.
b) ¿Cuántos litros de metano, oxígeno y amoniaco se requieren, y cuántos litros de agua se produjeron en la preparación de 15 L de HCN?
Debes suponer que todos los gases se encuentran en las mismas condiciones de presión y temperatura.
-
Relación volumétrica entre reactivos de una reacción
El amoniaco gaseoso reacciona con el oxígeno formado óxido de nitrógeno(IV) y agua. ¿Qué volumen de oxígeno se necesitará para reaccionar con 150 L de amoniaco? Considera que todos los gases están en condiciones normales de P y T.
-
Volumen de CO2 necesario para producir un gramo de glucosa (5561)
Calcula el volumen de 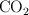 , a
, a  y 1 bar, que las plantas necesitan para producir 1 g de glucosa por fotosíntesis, siendo la reacción:
y 1 bar, que las plantas necesitan para producir 1 g de glucosa por fotosíntesis, siendo la reacción:

Datos: C =12 ; H = 1 ; O = 16 ; 1 bar = 0.987 atm.
 Gases
Gases