-
Problema equilibrio químico 0011
Cuando se mezclan 0,40 moles de gas xenón con 0,80 moles de gas flúor, en un recipiente de 2 litros a cierta temperatura, se observa que el 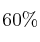 del xenón reacciona con el flúor formándose
del xenón reacciona con el flúor formándose 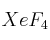 gaseoso.
gaseoso.
a) Calcula, a esa temperatura,  para la reacción:
para la reacción:
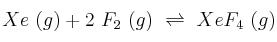
b) ¿Cuántos moles de 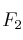 se deben añadir para que la conversión sea del
se deben añadir para que la conversión sea del 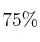 ?
?
-
Problema equilibrio químico 0010
A 1200 ºC, la constante de equilibrio para la reacción:
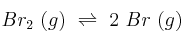
es 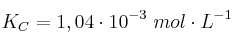 . Si la concentración inicial de bromo molecular es 1 M:
. Si la concentración inicial de bromo molecular es 1 M:
a) Calcula la concentración de bromo atómico en el equilibrio.
b) ¿Qué fracción de 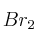 se encuentra disociada en átomos de bromo?
se encuentra disociada en átomos de bromo?
-
Problema equilibrio químico 0008
En un recipiente de un litro, a 500 K, se introduce un mol de cloruro de nitrosilo (ClNO). Cuando se alcanza el equilibrio, el ClNO se encuentra disociado en un 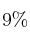 . Calcula, para la temperatura de 500 K, el valor de
. Calcula, para la temperatura de 500 K, el valor de  y
y  correspondiente al equilibrio:
correspondiente al equilibrio:
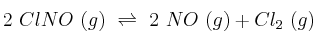
-
Problema equilibrio químico 0007
Para la reacción de disociación del 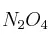 gaseoso,
gaseoso,  vale 2,49 atm a 60 ºC. Calcula el grado de disociación del
vale 2,49 atm a 60 ºC. Calcula el grado de disociación del 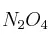 a 60 ºC y una presión total de 1 atm.
a 60 ºC y una presión total de 1 atm.
-
Selectividad Andalucía: química (junio 2009) - problema 2.B (124)
A 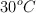 y 1 atm el
y 1 atm el 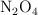 se encuentra disociado en un
se encuentra disociado en un 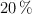 según el siguiente equilibrio:
según el siguiente equilibrio:

Calcula:
a) El valor de las constantes  y
y  , a esa temperatura.
, a esa temperatura.
b) El porcentaje de disociación a 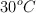 y 0.1 atm de presión total.
y 0.1 atm de presión total.
Dato: 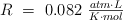 .
.
 Grado disociación
Grado disociación