-
Reacción química y estequiometría de un antiácido estomacal (2090)
Los antiácidos son productos que combaten la acidez estomacal. La mayoría de estos antiácidos siguen la reacción del bicarbonato de sodio (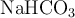 ) con el ácido cítrico (
) con el ácido cítrico (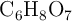 ), para dar citrato de sodio (
), para dar citrato de sodio (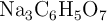 ), dióxido de carbono y agua.
), dióxido de carbono y agua.
a) Escribe y ajusta la reacción química.
b) Calcula la masa de ácido cítrico que debe utilizarse para que reaccionen 100 mg de bicarbonato de sodio.
c) Calcula la masa de 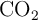 liberado en la reacción anterior.
liberado en la reacción anterior.
d) Calcula el volumen que ocupa dicho 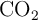 , medido a 1.45 atm y
, medido a 1.45 atm y 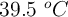 .
.
-
Reacción de combustión de hidrocarburo (2092)
Si un automóvil viaja 225 millas con un consumo de 20.05 millas/galón de gasolina, ¿Cuántos kilogramos de 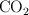 se producen?
se producen?
Supón que la gasolina está compuesta por octano , 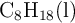 , cuya densidad es 0.69 g/mL.
, cuya densidad es 0.69 g/mL.
-
Relación estequiométrica y masa de reactivo 0001
Determina la masa de HCl necesaria para preparar 220 g de  según la ecuación:
según la ecuación:
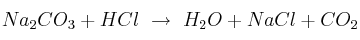
-
Reacción química y estequiometría (2084)
El ardor de estómago, también llamado hiperclorhidria, es debido a un exceso de cloruro de hidrógeno. Una de las formas tradicionales de calmarlo es tomando bicarbonato sódico. La reacción que tiene lugar es:
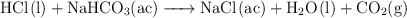
Si se han ingerido 10 g de bicarbonato:
a) ¿Qué cantidad de NaCl se formará?
b) ¿Qué volumen de  se genera en el cuerpo, suponiendo que la presión en el interior de nuestro cuerpo es 1 atm y la temperatura es
se genera en el cuerpo, suponiendo que la presión en el interior de nuestro cuerpo es 1 atm y la temperatura es 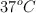 ?
?
-
Estequiometría y moles 0001
Si se hace reaccionar el trióxido de azufre con agua se obtiene el ácido sulfúrico (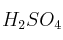 ). ¿Qué cantidad de ácido se obtendrá cuando reaccionen 500 g de trióxido de azufre?
). ¿Qué cantidad de ácido se obtendrá cuando reaccionen 500 g de trióxido de azufre?
 Ajuste
Ajuste