-
Ajuste y estequiometría de reacciones químicas 0001
Indica los moles de oxígeno gaseoso que se necesitan para quemar 1,20 moles de 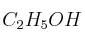 según la siguiente reacción (no ajustada):
según la siguiente reacción (no ajustada): 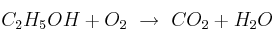
a)1,20 mol 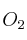
b)3 mol 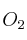
c)1,5 mol 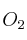
d) 3,60 mol 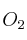
-
Reacciones químicas y reactivos en disolución 0002
Se prepara ácido clorhídrico por calentamiento de una mezcla de cloruro de sodio con ácido sulfúrico concentrado, según la reacción (sin ajustar):
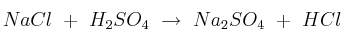
Calcula:
a) La masa, en gramos, de ácido sulfúrico del 90 de riqueza en peso que será necesario para producir 1 t de disolución concentrada de ácido clorhídrico del 42
de riqueza en peso que será necesario para producir 1 t de disolución concentrada de ácido clorhídrico del 42 en peso.
en peso.
b) La masa de cloruro de sodio consumida en el proceso.
Masas atómicas: H = 1 ; O = 16 ; Na = 23 ; S = 32 ; Cl = 35,5
-
Reacciones químicas con rendimiento 0001 (EvAU)
Se hacen reaccionar 10 g de cinc metálico con ácido sulfúrico en exceso. Calcula:
a) El volumen de hidrógeno que se obtiene medido a 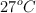 y 740 mm de Hg de presión.
y 740 mm de Hg de presión.
b) La masa de sulfato de cinc formada si la reacción tiene un rendimiento del 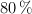 .
.
Datos: 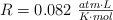 ; Zn = 65.4 ; S = 32 ; O = 16.
; Zn = 65.4 ; S = 32 ; O = 16.
-
Estequiometría de las reacciones químicas 0001
Se tratan 250 g de 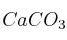 con ácido clorhídrico y se desea saber: a) la cantidad de HCl en peso necesaria; b) ¿qué cantidad de
con ácido clorhídrico y se desea saber: a) la cantidad de HCl en peso necesaria; b) ¿qué cantidad de  en peso se obtendrá?; c) ¿qué volumen de
en peso se obtendrá?; c) ¿qué volumen de  se obtendrá en condiciones normales?
se obtendrá en condiciones normales?
Pesos atómicos: C=12 ; O=16 ; H=1 ; Cl=35,4 ; Ca=40. La reacción sin ajustar es:
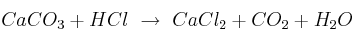
-
Reacciones químicas: estequiometría 0001
Cuando arden 25 g de un hidrocarburo, se forman 56,25 g de agua pura y 68,75 g de dióxido de carbono.
a) ¿Cuál es la composición centesimal de la muestra?
b) Calcula el número relativo de átomos de carbono e hidrógeno del compuesto de partida. ¿Podrías asegurar, sin datos adicionales, de qué compuesto se trata?
c) Calcula el número de moléculas de dióxido de carbono y de agua formadas, así como el de moles de dioxígeno necesarios para la combustión.
 Ajuste
Ajuste