-
Molaridad tras la dilución de una solución concentrada de ácido sulfúrico (1837)
Se toman 25 mL de un ácido sulfúrico de densidad 1.84 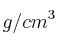 y del 96
y del 96 de riqueza en peso y se le adiciona agua hasta 250 mL.
de riqueza en peso y se le adiciona agua hasta 250 mL.
a) Calcula la molaridad de la disolución anterior.
b) Describe el material necesario y el procedimiento a seguir para preparar la disolución.
Masas atómicas: H = 1 ; S = 32 ; O = 16
-
Disoluciones: molaridad y fracción molar 0001
En una botella de ácido clorhídrico concentrado figuran los siguientes datos: 36 en masa, densidad 1,18 g/mL. Calcula:
en masa, densidad 1,18 g/mL. Calcula:
a) La molaridad de la disolución y la fracción molar del ácido.
b) El volumen de este ácido concentrado que se necesita para preparar un litro de disolución 2 M.
Masas atómicas: Cl = 35,5 ; H = 1 ; O = 16.
-
Estequiometría: Gases y disoluciones 0001
Se dispone de una disolución acuosa de HCl, cuya densidad es de 1,03 g/mL. Se toman 5 mL de esta disolución a los que se les va añadiendo cinc en polvo hasta que se observa que cesa el desprendimiento de gas, momento en el que se para la reacción y se mide que se han desprendido 70 mL de gas, medidos en c.n.
a) Indica la naturaleza del gas que se desprende.
b) Halla los gramos de cinc que han reaccionado en el HCl.
c) Halla la concentración en  en peso de la disolución de HCl.
en peso de la disolución de HCl.
d) ¿Cuál es la molaridad y la molalidad de la disolución de HCl?
-
Disoluciones: concentración molar 0001
Si mezclamos 100 mL de una disolución 0,1 M de HCl con 25 mL de otra disolución comercial de HCl al 30 (
(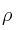 = 1,25 g/mL):
= 1,25 g/mL):
a) ¿Cuál es la concentración molar de la nueva disolución? Supón que los volúmenes son aditivos.
b) ¿Qué masa de HCl contiene la disolución?
c) ¿Cuántos átomos de cloro hay?
-
Disoluciones: molaridad 0002
Disolvemos 20 mL de una disolución de 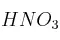 (15
(15 ) y densidad de 1,12 g/mL, con agua hasta un volumen final de 250 mL.
) y densidad de 1,12 g/mL, con agua hasta un volumen final de 250 mL.
a) ¿Cuál es la molaridad de la disolución?
b) ¿Cuántos átomos de nitrógeno habrá en 10 mL de ella?
 Molaridad
Molaridad