-
Disoluciones: molaridad (1556)
Determina la concentración molar de un suero glucosado que tiene una concentración del 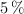 de glucosa. Supón que la densidad es 1 g/mL.
de glucosa. Supón que la densidad es 1 g/mL.
-
EBAU Andalucía: química (junio 2011) - ejercicio A.5 (1463)
A  una disolución acuosa de amoniaco contiene 0.17 g de este compuesto por litro y se encuentra disociado en un
una disolución acuosa de amoniaco contiene 0.17 g de este compuesto por litro y se encuentra disociado en un 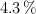 . Calcula:
. Calcula:
a) La concentración de iones hidroxilo y amonio.
b) La constante de disociación.
Masas atómicas: N = 14 ; H = 1.
-
Problema neutralización ácido-base 0006
A temperatura ambiente, la densidad de una disolución de ácido sulfúrico del 24 de riqueza en peso es de 1,17 g/mL. Calcula:
de riqueza en peso es de 1,17 g/mL. Calcula:
a) Su concentración molar.
b) El volumen de disolución necesario para neutralizar 100 mL de disolución 2,5 M de hidróxido potásico.
Datos: H = 1 ; S = 32 ; O = 16
-
Preparación de disoluciones 0001
Se prepara 1 L de disolución acuosa de ácido clorhídrico 0,5 M a partir de uno comercial de riqueza 35 en peso y 1,15 g/mL de densidad. Calcule:
en peso y 1,15 g/mL de densidad. Calcule:
a) El volumen de ácido concentrado necesario para preparar dicha disolución.
b) El volumen de agua que hay que añadir a 20 mL de HCl 0,5 M, para que la disolución pase a ser 0,01 M.
Suponga que los volúmenes son aditivos. Masas atómicas: H = 1; Cl = 35,5.
-
Problema disoluciones 0009
Disolvemos 25 mL de ácido nítrico 0,2 M con agua pura hasta un volumen total de 200 mL y la etiquetamos como "Disolución A". Se toman 30 mL de la disolución A y se llevan hasta 100 mL con agua pura para obtener la "Disolución B".
a) ¿Cuál es la molaridad de la disolución B?
b) ¿Cuántos átomos de nitrógeno contienen 2 mL de disolución B?
Datos: 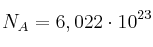 ; N: 14 ; O: 16 ; H: 1.
; N: 14 ; O: 16 ; H: 1.
 Molaridad
Molaridad