-
Reacción de oxidación del dióxido de azufre (841)
El dióxido de azufre ( ) se oxida con el oxígeno del aire para formar el trióxido de azufre (
) se oxida con el oxígeno del aire para formar el trióxido de azufre (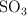 ). Suponiendo que la reacción tiene lugar en condiciones estándar (1 atm y 298 K), ¿qué volumen de
). Suponiendo que la reacción tiene lugar en condiciones estándar (1 atm y 298 K), ¿qué volumen de 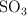 se obtendría si reaccionan 2.5 kg de
se obtendría si reaccionan 2.5 kg de  con exceso de oxígeno?
con exceso de oxígeno?
Datos: S = 32 ; O = 16.
-
Descomposición térmica del clorato de potasio (840)
El clorato potásico se descompone térmicamente según la reacción:
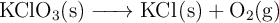
Si se calientan 15 g de 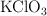 . Calcula:
. Calcula:
a) ¿Qué masa de KCl se obtendrá?
b) ¿Qué masa de oxígeno,  ?
?
c) ¿Qué volumen de oxígeno, medido en condiciones normales?
(Datos: K = 39 ; Cl = 35.5 ; O = 16)
-
Reacciones químicas: estequiometría de la reacción de formación del dióxido de nitrógeno (800)
La reacción de formación del dióxido de nitrógeno es:
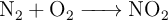
Si se hacen reaccionar 12 L de  (1 atm y
(1 atm y 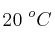 ) con exceso de nitrógeno:
) con exceso de nitrógeno:
a) ¿Cuántos moles de 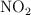 se obtendrán?
se obtendrán?
b) ¿Cuántos átomos de nitrógeno contienen?
c) ¿Cuántos átomos de oxígeno?
-
Cantidad de oxígeno y volumen de hidrógeno al descomponer agua (799)
El agua se puede descomponer en hidrógeno, 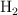 , y oxígeno,
, y oxígeno, 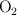 . Si tratamos 300 g de agua en una cuba electrolítica, ¿qué cantidad de oxígeno se obtendrá? ¿Qué volumen de hidrógeno se obtendrá, medido en condiciones normales?
. Si tratamos 300 g de agua en una cuba electrolítica, ¿qué cantidad de oxígeno se obtendrá? ¿Qué volumen de hidrógeno se obtendrá, medido en condiciones normales?
Masas atómicas: H = 1 ; O = 16.
-
Balanceo de reacciones químicas de distinto tipo (794)
Ajusta las siguientes reacciones químicas:
a) 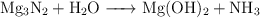
b) 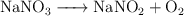
c) 
d) 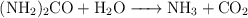
 Ajuste
Ajuste