-
Problema disoluciones 0013
Necesitamos preparar 500 mL de una disolución de hidróxido de sodio 2 M. Calcula qué cantidad de soluto necesitas y explica cómo la prepararás si dispones de un producto comercial del 95 de riqueza en NaOH.
de riqueza en NaOH.
Datos: Na = 23 ; H = 1 ; O = 16
-
Molaridad de una disolución y molaridad final tras su dilución
Se disuelven 12 g de nitrato de plata (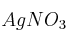 ) en agua hasta obtener una disolución de 250 mL. Calcula:
) en agua hasta obtener una disolución de 250 mL. Calcula:
a) La molaridad de la disolución.
b) La molaridad de otra disolución hecha a partir de 15 mL de la disolución anterior que son diluidos en agua destilada hasta un volumen de 100 mL.
Datos: Ag = 108 ; N = 14 ; O = 16
-
Volumen de ácido comercial para preparar una disolución 0.4 N (245)
Se desea preparar 200 mL de ácido clorhídrico 0.4 N a partir de un ácido clorhídrico comercial de 1.18 g/mL de densidad y una riqueza del 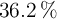 en peso. ¿Cuántos mL de ácido comercial se necesitan? Calcula la molaridad y la molalidad del ácido comercial.
en peso. ¿Cuántos mL de ácido comercial se necesitan? Calcula la molaridad y la molalidad del ácido comercial.
(Datos: H = 1 ; Cl = 35.5)
-
Molaridad de una disolución de sal en 250 mL de disolución (93)
Si se disuelven 20.36 g de NaCl en la suficiente cantidad de agua destilada para dar 250 mL de disolución. ¿Cuál es la concentración molar de NaCl?
Datos: Na = 23 ; Cl = 35.5
-
Volumen de disolución comercial para preparar una disolución de ácido sulfúrico (89)
Se dispone de una disolución acuosa de ácido sulfúrico, 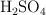 , del
, del 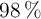 en masa y cuya densidad es de
en masa y cuya densidad es de 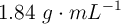 . ¿Qué volumen de esta disolución se necesita para preparar 10.0 L de una disolución 0.200 M de
. ¿Qué volumen de esta disolución se necesita para preparar 10.0 L de una disolución 0.200 M de 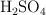 ?
?
 Molaridad
Molaridad