-
Masa de agua que se obtiene al mezclar masas distintas de hidrógeno y oxígeno (198)
Se hacen reaccionar 10 g de hidrógeno y 105 g de oxígeno para obtener agua. ¿Qué cantidad de agua será la que se obtenga?
Masas atómicas: H = 1 ; O = 16.
-
Estequiometría de las reacciones químicas, gases y disoluciones (106)
El cobre reacciona con ácido sulfúrico produciendo sulfato de cobre(II), dióxido de azufre y agua.
a) ¿Qué volumen de ácido sulfúrico al 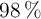 en peso y densidad 1.84 g/mL es necesario para obtener 100 L de dióxido de azufre, medidos en condiciones normales?
en peso y densidad 1.84 g/mL es necesario para obtener 100 L de dióxido de azufre, medidos en condiciones normales?
b) ¿Cuántos gramos de un mineral que contiene un 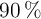 de pureza en cobre se necesitarán para obtener el volumen de dióxido de azufre anterior?
de pureza en cobre se necesitarán para obtener el volumen de dióxido de azufre anterior?
Datos: Cu = 63.5 ; S = 32 ; O = 16 ; H = 1.
-
Reacción entre el aluminio y el ácido clorhídrico (105)
El aluminio reacciona con el ácido clorhídrico dando cloruro de aluminio e hidrógeno. Se hacen reaccionar 100 g de una muestra de aluminio del 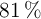 de pureza con ácido clorhídrico. Calcula:
de pureza con ácido clorhídrico. Calcula:
a) El volumen de disolución del ácido clorhídrico 5 M necesario para la reacción.
b) El volumen de hidrógeno gaseoso obtenido medido a 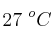 y 740 mm Hg.
y 740 mm Hg.
Datos: Al = 27 ; Cl = 35.45 ; H = 1.
-
Volumen de aire necesario para quemar dos litros y medio de gasolina (103)
La gasolina es una mezcla de hidrocarburos entre los que se encuentra el octano, 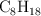 .
.
a) Escribe la reacción ajustada para la combustión del octano.
b) Sabiendo que el porcentaje de oxígeno en el aire es del 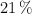 en volumen, calcula el volumen de aire, medido en condiciones normales, que se necesita para quemar 2.5 L de octano de densidad 0.703 kg/L.
en volumen, calcula el volumen de aire, medido en condiciones normales, que se necesita para quemar 2.5 L de octano de densidad 0.703 kg/L.
Datos: C = 12; O = 16; H = 1.
-
Cantidad de SO2 y volumen de aire al tostar pirita (99)
En la tostación de la pirita:
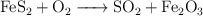
determina:
a) La cantidad de  que se obtiene al tostar 2 toneladas de pirita de un
que se obtiene al tostar 2 toneladas de pirita de un 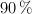 de riqueza, si el resto es ganga silícica.
de riqueza, si el resto es ganga silícica.
b) El volumen de aire, medido a 298.15 K y 1 atm de presión, que se necesita para tostar dicha cantidad de mineral. (El porcentaje de 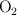 en el aire es del
en el aire es del 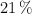 ).
).
Datos: Fe = 55.85 ; S = 32 ; O = 16
 Ajuste
Ajuste