-
Aplicación de la ley de Gay-Lussac con los datos de un experimento (1924)
En el laboratorio se obtienen los siguientes datos sobre un sistema gaseoso que ocupa un volumen fijo de 5 L:
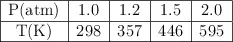
a) ¿Qué ley de los gases se cumple? ¿Cuál es el valor de la constante?
b) Representa gráficamente la isócora del experimento.
c) ¿Cuál sería la temperatura esperada cuando la presión sea 2.8 atm?
-
Ley general de los gases (1920)
Calcula la temperatura final de un gas encerrado en un volumen de 2 L, a 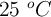 y 1 atm, si reducimos su volumen hasta los 0.5 L y su presión aumenta hasta 3.8 atm.
y 1 atm, si reducimos su volumen hasta los 0.5 L y su presión aumenta hasta 3.8 atm.
-
Ley de Boyle (1919)
Si introducimos cierta cantidad de gas en un recipiente de 2 L y lo cerramos herméticamente a una presión de 1 atm, ¿cuál será la presión final si reducimos el volumen a un tercio de litro? ¿Qué ley de los gases aplicas para resolver el problema? Considera que la temperatura es constante.
-
Moles, moléculas y átomos (1835)
En 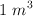 de metano (
de metano (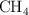 ), medido en condiciones normales de presión y temperatura, calcula:
), medido en condiciones normales de presión y temperatura, calcula:
a) El número de moles de metano.
b) El número de moléculas de metano.
c) El número de átomos de hidrógeno.
-
Ecuación de estado de los gases perfectos 0001
Define las transformaciones termodinámicas principales. ¿Cuál es la ecuación de estado para los gases perfectos?
 Leyes de los gases
Leyes de los gases