-
Problema de estequiometría 0009
El cinc es atacado por el ácido clorhídrico y su reacción desprende hidrógeno. Si una muestra de 15 g se hace reaccionar con ácido en exceso y libera 3,44 L de hidrógeno medidos a 27 ºC y 1 atm:
a) ¿Cuál es la riqueza de la muestra?
b) ¿Qué volumen de ácido 0,3 M haría falta para tratar 1,5 g de muestra?
Datos: Zn = 65,4 u ; Cl = 35,5 u ; H = 1 u ; R = 0,082 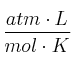
-
Estequiometría de las reacciones químicas, gases y disoluciones (106)
El cobre reacciona con ácido sulfúrico produciendo sulfato de cobre(II), dióxido de azufre y agua.
a) ¿Qué volumen de ácido sulfúrico al 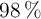 en peso y densidad 1.84 g/mL es necesario para obtener 100 L de dióxido de azufre, medidos en condiciones normales?
en peso y densidad 1.84 g/mL es necesario para obtener 100 L de dióxido de azufre, medidos en condiciones normales?
b) ¿Cuántos gramos de un mineral que contiene un 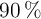 de pureza en cobre se necesitarán para obtener el volumen de dióxido de azufre anterior?
de pureza en cobre se necesitarán para obtener el volumen de dióxido de azufre anterior?
Datos: Cu = 63.5 ; S = 32 ; O = 16 ; H = 1.
-
Reacción entre el aluminio y el ácido clorhídrico (105)
El aluminio reacciona con el ácido clorhídrico dando cloruro de aluminio e hidrógeno. Se hacen reaccionar 100 g de una muestra de aluminio del 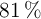 de pureza con ácido clorhídrico. Calcula:
de pureza con ácido clorhídrico. Calcula:
a) El volumen de disolución del ácido clorhídrico 5 M necesario para la reacción.
b) El volumen de hidrógeno gaseoso obtenido medido a 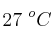 y 740 mm Hg.
y 740 mm Hg.
Datos: Al = 27 ; Cl = 35.45 ; H = 1.
-
Problema de estequiometría 0006
El cinc se disuelve en ácido sulfúrico formando sulfato de cinc e hidrógeno. ¿Qué masa de cinc puede disolverse en 500 mL de ácido sulfúrico al 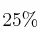 en peso y de densidad 1,09 g/mL? ¿Qué volumen de hidrógeno, medido en condiciones normales, se desprenderá en la reacción?
en peso y de densidad 1,09 g/mL? ¿Qué volumen de hidrógeno, medido en condiciones normales, se desprenderá en la reacción?
Datos: Zn = 65,41 ; S = 32 ; O = 16 ; H = 1
-
Estequiometría: reacción entre cinc y ácido clorhídrico (14)
El ácido clorhídrico reacciona con cinc para dar hidrógeno y cloruro de cinc. ¿Cuántos litros de hidrógeno (medidos a 1 atm y 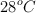 ) se obtienen a partir de 150 g de una disolución del ácido al
) se obtienen a partir de 150 g de una disolución del ácido al 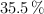 ?
?
Datos: Zn = 65.37 ; Cl = 35.45 ; H = 1.
 Disoluciones
Disoluciones