-
Calor de combustión de un compuesto 0001
¿Cuál es la cantidad de energía que libera la combustión de 440 g de propano?
El calor de combustión del propano es -526 kJ/mol.
-
Entalpías de formación, entropía y espontaneidad 0001
Las entalpías estándar de formación del etano y del eteno son -84,7 kJ/mol y 52,3 kJ/mol, respectivamente. Sabiendo que la variación de entropía del proceso 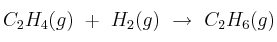 es
es 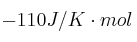 , indica de forma razonada si el proceso será espontáneo en condiciones estándar.
, indica de forma razonada si el proceso será espontáneo en condiciones estándar.
-
Entalpía de reacción a partir de entalpías de formación (1986)
El etano reacciona con el ácido nítrico, a alta temperatura, para dar nitroetano y agua, siendo todo el proceso homogéneo y en fase gaseosa. Calcula:
a) La entalpía de reacción para el proceso.
b) El volumen de nitroetano que se obtendría cuando la energía intercambiada en el proceso es 400 kJ, si la temperatura es 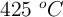 y la presión una atmósfera.
y la presión una atmósfera.
Datos: 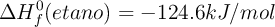 ;
; 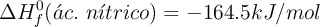 ;
;  ;
; 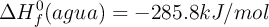
-
EBAU Andalucía: química (junio 2012) - ejercicio B.3 (1958)
En una reacción endotérmica:
a) Dibuja el diagrama entálpico de la reacción.
b) ¿Cuál es mayor, la energía de activación directa o la inversa?
c) ¿Cómo afectará al diagrama anterior la adición de un catalizador?
-
Selectividad septiembre 2012: Energía de enlace y energía interna 0001
a) Calcula la variación de entalpía de formación del amoniaco, a partir de los siguientes datos de energías de enlace: E (H-H) = 436 kJ/mol; E (N-H) = 389 kJ/mol; E (N≡N) = 945 kJ/mol.
b) Calcula la variación de energía interna en la formación del amoniaco a la temperatura de 25 ºC.
Dato: R=8,31 J·K-1·mol-1.
 Entalpía
Entalpía