-
Redox: Método ion-electrón y estequiometría 0002
Dada la siguiente reacción redox en disolución acuosa:
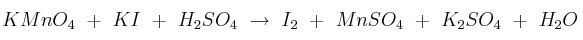
a) Ajustar la reacción por el método del ión-electrón.
b) Calcula los litros de disolución 2 M de permanganato de potasio necesarios para obtener 1 kg de yodo.
Masas atómicas: I = 127; K = 39; O = 16; Mn = 55
-
Ajuste ion-electrón y estequiometría selectividad junio 2012
El dióxido de manganeso reacciona en medio de hidróxido de potasio con clorato de potasio para dar permanganato de potasio, cloruro de potasio y agua.
a) Ajusta la ecuación molecular por el método del ion-electrón.
b) Calcula la riqueza en dióxido de manganeso de una muestra si 1 g de la misma reacciona exactamente con 0,35 g de clorato de potasio
Datos: O = 16 ; K = 39 ; Mn = 55 ; Cl = 35,5
-
Reacción redox: ajuste y estequiometría 0003
En disolución acuosa y en medio ácido sulfúrico, el sulfato de hierro(II) reacciona con permanganato de potasio para dar sulfato de manganeso(II), sulfato de hierro(III) y sulfato de potasio.
a) Escribe y ajusta las correspondientes reacciones iónicas y la molecular del proceso por el método del ion-electrón.
b) Calcula la concentración molar de una disolución de sulfato de hierro(II) si 10 mL de esta disolución han consumido 22,3 mL de una disolución acuosa de permanganato de potasio 0,02 M.
-
Reacción redox: ajuste y estequiometría 0002
Cuando se hace reaccionar dicromato de potasio con ácido clorhídrico se obtienen tricloruro de cromo y dicloro como productos de reacción. Si hacemos reaccionar 34,5 g de dicromato de potasio con exceso de ácido, ¿qué volumen de cloro, medido a 28 ºC y 1 atm, se obtendrá?
Datos: K = 39 ; Cr = 52 ; O = 16
-
Ajuste redox en medio básico 0001
Ajusta la siguiente reacción redox por el método ion-electrón y calcula la masa de hidróxido de sodio que será necesaria para hacer reaccionar 35 g de la sal de cromo:
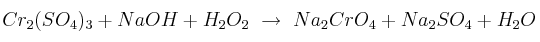
Datos: Cr = 52 ; S =32 ; O = 16 ; Na = 23 ; H = 1
 Estequiometría
Estequiometría