-
Estequiometría de las reacciones químicas, gases y disoluciones (106)
El cobre reacciona con ácido sulfúrico produciendo sulfato de cobre(II), dióxido de azufre y agua.
a) ¿Qué volumen de ácido sulfúrico al 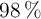 en peso y densidad 1.84 g/mL es necesario para obtener 100 L de dióxido de azufre, medidos en condiciones normales?
en peso y densidad 1.84 g/mL es necesario para obtener 100 L de dióxido de azufre, medidos en condiciones normales?
b) ¿Cuántos gramos de un mineral que contiene un 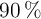 de pureza en cobre se necesitarán para obtener el volumen de dióxido de azufre anterior?
de pureza en cobre se necesitarán para obtener el volumen de dióxido de azufre anterior?
Datos: Cu = 63.5 ; S = 32 ; O = 16 ; H = 1.
-
Volumen y moéculas de oxígeno que se obtienen al descomponer KClO3 impuro (100)
El clorato de potasio se descompone por el calor en cloruro de potasio y oxígeno molecular. ¿Qué volumen de oxígeno, a 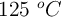 y una atmósfera de presión, puede obtenerse por descomposición de 148 g de una muestra que contiene el
y una atmósfera de presión, puede obtenerse por descomposición de 148 g de una muestra que contiene el 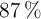 en peso de clorato potásico? ¿Cuántas moléculas de oxígeno se formarán?
en peso de clorato potásico? ¿Cuántas moléculas de oxígeno se formarán?
Datos: Cl = 35.45 ; O = 16 ; K = 39.1
-
Cantidad de SO2 y volumen de aire al tostar pirita (99)
En la tostación de la pirita:
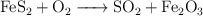
determina:
a) La cantidad de  que se obtiene al tostar 2 toneladas de pirita de un
que se obtiene al tostar 2 toneladas de pirita de un 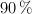 de riqueza, si el resto es ganga silícica.
de riqueza, si el resto es ganga silícica.
b) El volumen de aire, medido a 298.15 K y 1 atm de presión, que se necesita para tostar dicha cantidad de mineral. (El porcentaje de 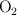 en el aire es del
en el aire es del 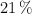 ).
).
Datos: Fe = 55.85 ; S = 32 ; O = 16
 Pureza
Pureza