-
Aplicación Principio Le Chatelier 0001
Supón el siguiente sistema en equilibrio: 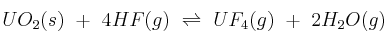 . Explica hacia dónde se desplaza el equilibrio cuando:
. Explica hacia dónde se desplaza el equilibrio cuando:
a) Se adiciona 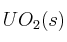 al sistema.
al sistema.
b) Se elimina HF(g).
c) Se aumenta la capacidad del recipiente de reacción.
-
Constantes de equilibrio: Dependencia de la temperatura 0001
A 613 K, el valor de  para la reacción:
para la reacción: 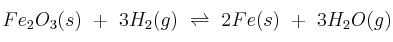 es 0,064. Si en el equilibrio anterior la presión parcial del hidrógeno es una atmósfera, calcula:
es 0,064. Si en el equilibrio anterior la presión parcial del hidrógeno es una atmósfera, calcula:
a) La concentración de hidrógeno.
b) La presión total.
-
Entalpía, entropía y espontaneidad 0001
Indica razonadamente si las siguientes afirmaciones son verdaderas o falsas:
a) Toda reacción exotérmica es espontánea.
b) En toda reacción química espontánea, la variación de entropía es positiva.
c) En el cambio de estado  se produce un aumento de entropía.
se produce un aumento de entropía.
-
Entalpía estándar de formación y calor desprendido 0001
a) Calcula la variación de entalpía estándar de formación del acetileno (etino) a partir de las entalpías estándares de combustión (kJ/mol) de hidrógeno, C (grafito) y acetileno cuyos valores son, respectivamente: -285,3; -393,3 y -1298,3.
b) Calcula el calor desprendido, a presión constante, cuando se quema 1 kg de acetileno.
Masas atómicas: H = 1 ; C =12.
-
Variación de entalpía y energía de reacción 0001
a) Calcula la variación de entalpía estándar correspondiente a la reacción:
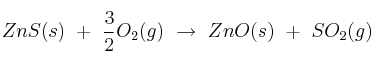
b) ¿Qué calor se absorbe o desprende , presión constante, cuando reaccionan 100 g de ZnS(s) con oxígeno en exceso?
Datos: ![\Delta H_f^0[ZnS(s)] = -202,9\ kJ/mol \Delta H_f^0[ZnS(s)] = -202,9\ kJ/mol](local/cache-TeX/3fd3201f80bdc01e15e15ca27fada880.png) ;
; ![\Delta H_f^0[ZnO(s)] = -348\ kJ/mol \Delta H_f^0[ZnO(s)] = -348\ kJ/mol](local/cache-TeX/b6fdead2c1454427ec936ca85df77e1f.png) ;
; ![\Delta H_f^0[SO_2(g)] = -296,1\ kJ/mol \Delta H_f^0[SO_2(g)] = -296,1\ kJ/mol](local/cache-TeX/741f3e5f894641bf511c52ba9f9a66fb.png) . Masas atómicas: S = 32 ; O = 16 ; Zn = 65,4.
. Masas atómicas: S = 32 ; O = 16 ; Zn = 65,4.
 EBAU
EBAU