-
Disoluciones: molaridad y fracción molar 0001
En una botella de ácido clorhídrico concentrado figuran los siguientes datos: 36 en masa, densidad 1,18 g/mL. Calcula:
en masa, densidad 1,18 g/mL. Calcula:
a) La molaridad de la disolución y la fracción molar del ácido.
b) El volumen de este ácido concentrado que se necesita para preparar un litro de disolución 2 M.
Masas atómicas: Cl = 35,5 ; H = 1 ; O = 16.
-
Disoluciones: molalidad y presión de vapor 0001
A 25 ºC se disuelven 4,36 g de urea ![[CO(NH_2)_2] [CO(NH_2)_2]](local/cache-TeX/bf6f592c0a9d99353d848f520f1f61fe.png) en 210 g de agua. Calcula:
en 210 g de agua. Calcula:
a) La molalidad de la disolución.
b) La presión de vapor de la misma.
Dato: La presión de vapor del agua a 25 ºC es igual a 23,76 mm Hg.
-
Disoluciones: concentración molar 0001
Si mezclamos 100 mL de una disolución 0,1 M de HCl con 25 mL de otra disolución comercial de HCl al 30 (
(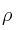 = 1,25 g/mL):
= 1,25 g/mL):
a) ¿Cuál es la concentración molar de la nueva disolución? Supón que los volúmenes son aditivos.
b) ¿Qué masa de HCl contiene la disolución?
c) ¿Cuántos átomos de cloro hay?
-
Disoluciones: molaridad 0002
Disolvemos 20 mL de una disolución de 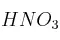 (15
(15 ) y densidad de 1,12 g/mL, con agua hasta un volumen final de 250 mL.
) y densidad de 1,12 g/mL, con agua hasta un volumen final de 250 mL.
a) ¿Cuál es la molaridad de la disolución?
b) ¿Cuántos átomos de nitrógeno habrá en 10 mL de ella?
-
Disoluciones: molaridad (1556)
Determina la concentración molar de un suero glucosado que tiene una concentración del 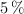 de glucosa. Supón que la densidad es 1 g/mL.
de glucosa. Supón que la densidad es 1 g/mL.
 Concentración
Concentración