-
Moles, moléculas y átomos 0002
Razona sin son verdaderas o falsas las siguientes afirmaciones:
a) Dos masas iguales de los elementos A y B contienen el mismo número de átomos.
b) La masa atómica de un elemento es la masa, en gramos, de un átomo de dicho elemento.
c) El número de átomos que hay en 5 g de oxígeno atómico es igual al número de moléculas que hay en 10 g de oxígeno molecular.
-
Molaridad tras la dilución de una solución concentrada de ácido sulfúrico (1837)
Se toman 25 mL de un ácido sulfúrico de densidad 1.84 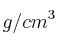 y del 96
y del 96 de riqueza en peso y se le adiciona agua hasta 250 mL.
de riqueza en peso y se le adiciona agua hasta 250 mL.
a) Calcula la molaridad de la disolución anterior.
b) Describe el material necesario y el procedimiento a seguir para preparar la disolución.
Masas atómicas: H = 1 ; S = 32 ; O = 16
-
Moles, moléculas y átomos (1835)
En 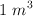 de metano (
de metano (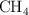 ), medido en condiciones normales de presión y temperatura, calcula:
), medido en condiciones normales de presión y temperatura, calcula:
a) El número de moles de metano.
b) El número de moléculas de metano.
c) El número de átomos de hidrógeno.
-
Reacciones químicas con rendimiento 0001 (EvAU)
Se hacen reaccionar 10 g de cinc metálico con ácido sulfúrico en exceso. Calcula:
a) El volumen de hidrógeno que se obtiene medido a 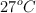 y 740 mm de Hg de presión.
y 740 mm de Hg de presión.
b) La masa de sulfato de cinc formada si la reacción tiene un rendimiento del 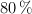 .
.
Datos: 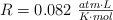 ; Zn = 65.4 ; S = 32 ; O = 16.
; Zn = 65.4 ; S = 32 ; O = 16.
-
Leyes de los gases, moléculas y átomos 0002
Razona qué cantidad de las siguientes sustancias tiene mayor número de átomos: a) 0,5 moles de 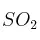 ; b) 14 gramos de nitrógeno molecular ; c) 67,2 litros de gas helio en condiciones normales de presión y temperatura.
; b) 14 gramos de nitrógeno molecular ; c) 67,2 litros de gas helio en condiciones normales de presión y temperatura.
Datos: N = 14 ; S = 32 ; O = 16
 EBAU
EBAU