-
Entalpías de formación y de reacción 0001
Sabiendo que las entalpías de formación de las sustancias que intervienen en el proceso: 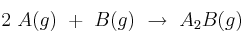 son
son ![\Delta H^0_f[A(g)] = -212,5\ kJ/mol \Delta H^0_f[A(g)] = -212,5\ kJ/mol](local/cache-TeX/6c672686251b2aa2138107c12c779e65.png) y
y ![\Delta H^0_f[B(g)] = -89,7\ kJ/mol \Delta H^0_f[B(g)] = -89,7\ kJ/mol](local/cache-TeX/3ef6ca757323da9699c1807f1f4e7059.png) y que la reacción anterior desprende 104 kJ cuando reaccionan 0,45 moles de A, ¿cuál es la entalpía de formación del
y que la reacción anterior desprende 104 kJ cuando reaccionan 0,45 moles de A, ¿cuál es la entalpía de formación del 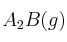 ?
?
-
Entalpía, entropía y espontaneidad 0001
Indica razonadamente si las siguientes afirmaciones son verdaderas o falsas:
a) Toda reacción exotérmica es espontánea.
b) En toda reacción química espontánea, la variación de entropía es positiva.
c) En el cambio de estado  se produce un aumento de entropía.
se produce un aumento de entropía.
-
Entalpía estándar de formación y calor desprendido 0001
a) Calcula la variación de entalpía estándar de formación del acetileno (etino) a partir de las entalpías estándares de combustión (kJ/mol) de hidrógeno, C (grafito) y acetileno cuyos valores son, respectivamente: -285,3; -393,3 y -1298,3.
b) Calcula el calor desprendido, a presión constante, cuando se quema 1 kg de acetileno.
Masas atómicas: H = 1 ; C =12.
-
Variación de entalpía y energía de reacción 0001
a) Calcula la variación de entalpía estándar correspondiente a la reacción:
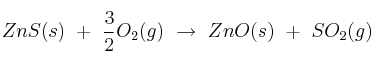
b) ¿Qué calor se absorbe o desprende , presión constante, cuando reaccionan 100 g de ZnS(s) con oxígeno en exceso?
Datos: ![\Delta H_f^0[ZnS(s)] = -202,9\ kJ/mol \Delta H_f^0[ZnS(s)] = -202,9\ kJ/mol](local/cache-TeX/3fd3201f80bdc01e15e15ca27fada880.png) ;
; ![\Delta H_f^0[ZnO(s)] = -348\ kJ/mol \Delta H_f^0[ZnO(s)] = -348\ kJ/mol](local/cache-TeX/b6fdead2c1454427ec936ca85df77e1f.png) ;
; ![\Delta H_f^0[SO_2(g)] = -296,1\ kJ/mol \Delta H_f^0[SO_2(g)] = -296,1\ kJ/mol](local/cache-TeX/741f3e5f894641bf511c52ba9f9a66fb.png) . Masas atómicas: S = 32 ; O = 16 ; Zn = 65,4.
. Masas atómicas: S = 32 ; O = 16 ; Zn = 65,4.
-
Variación de energía interna y entalpía 0001
El amoniaco, a 25 ºC y 1 atm, se puede oxidar según la reacción:
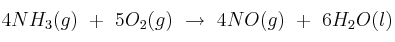
Calcula: a) La variación de la entapía. b) La variación de la energía interna.
Datos: 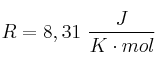 ;
; ![\Delta H_f^0[NH_3(g)] = -46,2\ kJ/mol \Delta H_f^0[NH_3(g)] = -46,2\ kJ/mol](local/cache-TeX/a0f7a33fde51c16458139958e3c2c708.png) ;
; ![\Delta H_f^0[NO(g)] = 90,4\ kJ/mol \Delta H_f^0[NO(g)] = 90,4\ kJ/mol](local/cache-TeX/4d7f5ebfb867a2cba426fb51d2d19240.png) ;
; ![\Delta H_f^0[H_2O(l)] = -285,8\ kJ/mol \Delta H_f^0[H_2O(l)] = -285,8\ kJ/mol](local/cache-TeX/67c256cddaa968343d3ba31e994123ea.png)
 Entalpía
Entalpía