-
PAU cinética química 0003
La reacción en fase gaseosa 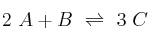 es una reacción elemental.
es una reacción elemental.
a) Formula la expresión para la ecuación de la velocidad.
b) Indica las unidades de la velocidad de reacción y de la constante cinética.
c) Justifica cómo afecta a la velocidad de reacción un aumento de la temperatura, a volumen constante.
d) Justifica cómo afecta a la velocidad de reacción un aumento del volumen, a temperatura constante.
-
Cuestión cinética química 0004
Explica de forma razonada por qué un aumento de la temperatura provoca un aumento mucho mayor de la velocidad de reacción.
-
PAU cinética química 0002
Se determinó experimentalmente que la reacción 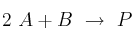 sigue la ecuación de velocidad
sigue la ecuación de velocidad ![v = k\ [B]^2 v = k\ [B]^2](local/cache-TeX/2d7071c3aa2dc2b8c2ad79f84d1b0847.png) . Contesta de forma razonada si las siguientes proposiciones son verdaderas o falsas:
. Contesta de forma razonada si las siguientes proposiciones son verdaderas o falsas:
a) La velocidad de desaparición de B es la mitad de la velocidad de formación de P.
b) La concentración de P aumenta a medida que disminuyen las concentraciones de A y B.
c) El valor de la constante de velocidad es función solamente de la concentración inicial de B.
d) El orden total de la reacción es 3.
-
Cuestión cinética química 0003
Define velocidad de reacción, orden de reacción y molecularidad. Explica sus posibles diferencias para el caso:
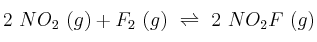
y justifica cómo se lograría aumentar más la rapidez de la reacción:
a) Duplicando la cantidad inicial de dióxido de nitrógeno.
b) Duplicando la cantidad inicial de flúor.
-
PAU cinética química 0001
La reacción en fase gaseosa 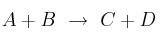 es endotérmica y su ecuación cinética es
es endotérmica y su ecuación cinética es ![v = k\ [A]^2 v = k\ [A]^2](local/cache-TeX/646c54a5bd43454d18e4d3ed9d26f84e.png) . Justifica si las siguientes afirmaciones son verdaderas o falsas:
. Justifica si las siguientes afirmaciones son verdaderas o falsas:
a) El reactivo A se consume más rápido que el B.
b) Un aumento de presión total produce un aumento de la velocidad de la reacción.
c) Una vez iniciada la reacción, la velocidad de reacción es constante si la temperatura no varía.
d) Por ser endotérmica, un aumento de temperatura disminuye la velocidad de reacción.
 Velocidad reacción
Velocidad reacción