-
Oxidación-reducción: Ajustar semirreacciones 0001
El ácido sulfúrico concentrado reacciona con el bromuro de potasio según la reacción:
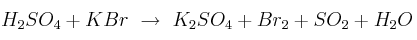
Ajustar por el método ión-electrón la ecuación iónica y molécular y escribir las dos semirreacciones redox.
-
Ajuste ion-electrón y estequiometría 0001
El ácido sulfúrico concentrado reacciona con el bromuro de potasio según la reacción:
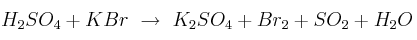
a) Ajusta, por el método del ion-electrón, la reacción anterior.
b) Calcula el volumen de bromo líquido (densidad 2,92 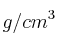 ) que se obtendrá al tratar 90,1 g de bromuro de potasio con suficiente cantidad de ácido sulfúrico.
) que se obtendrá al tratar 90,1 g de bromuro de potasio con suficiente cantidad de ácido sulfúrico.
Masas atómicas: K = 39; Br = 80
-
Reacciones redox: Ajuste y estequiometría 0002
Dada la reacción redox en disolución acuosa:
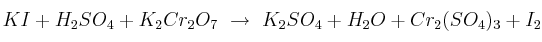
a) Ajuste por el método del ion-electrón la reacción.
b) Calcule la molaridad de la disolución de dicromato de potasio, si 30 mL de la misma reaccionan con 60 mL de una disolución que contiene 80 g/L de yoduro de potasio.
Masas atómicas: O = 16; K = 39; Cr = 52; I = 127
-
Redox: Método ion-electrón y estequiometría 0002
Dada la siguiente reacción redox en disolución acuosa:
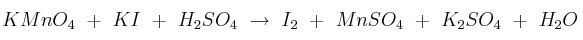
a) Ajustar la reacción por el método del ión-electrón.
b) Calcula los litros de disolución 2 M de permanganato de potasio necesarios para obtener 1 kg de yodo.
Masas atómicas: I = 127; K = 39; O = 16; Mn = 55
-
Reacción redox: ajuste y estequiometría 0003
En disolución acuosa y en medio ácido sulfúrico, el sulfato de hierro(II) reacciona con permanganato de potasio para dar sulfato de manganeso(II), sulfato de hierro(III) y sulfato de potasio.
a) Escribe y ajusta las correspondientes reacciones iónicas y la molecular del proceso por el método del ion-electrón.
b) Calcula la concentración molar de una disolución de sulfato de hierro(II) si 10 mL de esta disolución han consumido 22,3 mL de una disolución acuosa de permanganato de potasio 0,02 M.
 Ion-electrón
Ion-electrón