-
Estequiometría de las reacciones químicas 0001
Se tratan 250 g de 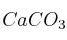 con ácido clorhídrico y se desea saber: a) la cantidad de HCl en peso necesaria; b) ¿qué cantidad de
con ácido clorhídrico y se desea saber: a) la cantidad de HCl en peso necesaria; b) ¿qué cantidad de  en peso se obtendrá?; c) ¿qué volumen de
en peso se obtendrá?; c) ¿qué volumen de  se obtendrá en condiciones normales?
se obtendrá en condiciones normales?
Pesos atómicos: C=12 ; O=16 ; H=1 ; Cl=35,4 ; Ca=40. La reacción sin ajustar es:
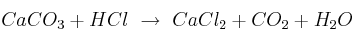
-
Reacciones químicas: estequiometría 0001
Cuando arden 25 g de un hidrocarburo, se forman 56,25 g de agua pura y 68,75 g de dióxido de carbono.
a) ¿Cuál es la composición centesimal de la muestra?
b) Calcula el número relativo de átomos de carbono e hidrógeno del compuesto de partida. ¿Podrías asegurar, sin datos adicionales, de qué compuesto se trata?
c) Calcula el número de moléculas de dióxido de carbono y de agua formadas, así como el de moles de dioxígeno necesarios para la combustión.
-
Estequiometría: pureza y disoluciones 0001
Se hacen reaccionar 200 g de piedra caliza, que contiene un 60 de carbonato de calcio, con una disolución de HCl de una concentración en peso del 30
de carbonato de calcio, con una disolución de HCl de una concentración en peso del 30 y densidad 1,150 g/mL. el proceso transcurre a 17 ºC y 740 mm Hg. Calcula:
y densidad 1,150 g/mL. el proceso transcurre a 17 ºC y 740 mm Hg. Calcula:
a) La masa de cloruro de calcio obtenido.
b) El volumen de dióxido de carbono producido en las condiciones de la reacción.
-
Estequiometría de una reacción de combustión de dos reactivos (1605)
Para quemar completamente un mezcla equimolecular de etano y acetileno han sido necesarios 240 mL de oxígeno, medidos en c.n. ¿Qué masa de ambos gases existía en la mezcla primitiva?
-
Estequiometría: rendimiento de la reacción 0002
a) Se han obtenido 14 g de CaO por descomposición térmica del carbonato de calcio. ¿Qué cantidad de éste habrá reaccionado? ¿Qué volumen ocupa el  desprendido, medido en condiciones normales?
desprendido, medido en condiciones normales?
b) Si el rendimiento de la reacción hubiese sido del 70 , ¿qué cantidad de carbonato de calcio se hubiese necesitado para obtener el mismo óxido de calcio?
, ¿qué cantidad de carbonato de calcio se hubiese necesitado para obtener el mismo óxido de calcio?
 Reacciones químicas
Reacciones químicas