-
Reacciones químicas: pureza de los reactivos 0002
Determina la pureza de una muestra de trioxidoclorato de potasio si 40 g de la misma, al descomponerse térmicamente en cloruro de potasio y dioxígeno, produjo 9,6 L de este último en c.n.
-
Reacciones químicas: riqueza de los reactivos (1592)
Para determinar la riqueza de una muestra de cinc se toman 50 g de la misma y se tratan con una disolución de ácido clorhídrico del 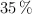 en peso de riqueza y densidad 1.18 g/mL, consumiéndose 129 mL. Calcula el porcentaje de cinc de la muestra y la molaridad de la disolución de ácido clorhídrico.
en peso de riqueza y densidad 1.18 g/mL, consumiéndose 129 mL. Calcula el porcentaje de cinc de la muestra y la molaridad de la disolución de ácido clorhídrico.
Masas atómicas 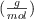 : Zn = 65.4 ; H = 1 ; Cl = 35.5
: Zn = 65.4 ; H = 1 ; Cl = 35.5
-
Reacciones químicas: estequiometría, disoluciones y gases 0001
El carbonato de magnesio reacciona con el trihidrógeno(tetraoxidofosfato) y da lugar al fosfato de magnesio, dióxido de carbono y agua.
a) Escribe la ecuación química.
b) Si se mezclan 22 g de carbonato de magnesio y 37 mL de ácido fosfórico (densidad = 1,34 g/mL y riqueza 50 en peso), ¿qué volumen de dióxido de carbono se obtiene, medido a 23 ºC y una presión de 743 mm Hg.
en peso), ¿qué volumen de dióxido de carbono se obtiene, medido a 23 ºC y una presión de 743 mm Hg.
-
Reacciones químicas: pureza de los reactivos 0001
Se desean obtener 5 L de oxígeno, medidos a 15 ºC y 725 mm Hg, por descomposición del clorato de potasio en oxígeno y cloruro de potasio. ¿Qué peso de clorato de potasio comercial, que contiene un 96,5 en peso puro, es necesario utilizar?
en peso puro, es necesario utilizar?
-
Estequiometría y reactivo limitante 0001
El cloruro de sodio reacciona con nitrato de plata precipitando totalmente cloruro de plata y obteniéndose además nitrato de sodio. Calcule:
a) La masa de cloruro de plata que se obtiene a partir de 100 mL de disolución de nitrato de plata 0,5 M y de 100 mL de disolución de cloruro de sodio 0,4 M.
b) Los gramos del reactivo en exceso.
Masas atómicas: O = 16; Na = 23; N = 14; Cl = 35,5; Ag = 108.
 Reacciones químicas
Reacciones químicas