-
EBAU Andalucía: química (junio 2011) - ejercicio A.6 (1464)
En disolución acuosa el ácido sulfúrico reacciona con cloruro de bario precipitando totalmente sulfato de bario y obteniéndose además ácido clorhídrico. Calcula:
a) El volumen de una disolución de ácido sulfúrico, de 1.84 g/mL de densidad y 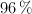 de riqueza en masa, necesario para que reaccionen totalmente 21.6 g de cloruro de bario.
de riqueza en masa, necesario para que reaccionen totalmente 21.6 g de cloruro de bario.
b) La masa de sulfato de bario que se obtendrá.
Masas atómicas: H = 1 ; O = 16 ; S = 32 ; Ba = 137.4 ; Cl = 35.5
-
Entalpía de formación y calor de combustión 0002
La entalpía de combustión de un hidrocarburo gaseoso 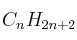 es -2220 kJ/mol. Calcule:
es -2220 kJ/mol. Calcule:
a) La fórmula molecular de este hidrocarburo.
b) La energía desprendida en la combustión de 50 L de este gas, medidos a 25 ºC y 1 atm.
c) La masa de 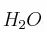 (l) que se obtendrá en la combustión anterior.
(l) que se obtendrá en la combustión anterior.
Datos: R = 0,082 atm·L/K·mol ; Entalpías de formación (kJ/mol):  (g) = -393 ;
(g) = -393 ; 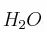 (l) = -286 ;
(l) = -286 ; 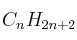 = -106 ; Masas atómicas: H = 1 ; O = 16 ; C = 12.
= -106 ; Masas atómicas: H = 1 ; O = 16 ; C = 12.
-
Reacción redox: Ajuste y estequiometría (1399)
El ácido sulfúrico reacciona con el bromuro de potasio para dar sulfato de potasio, bromo, dióxido de azufre y agua. ¿Cuántos litros de dióxido de azufre, en c.n, se obtienen a partir de 50 g de bromuro de potasio? (K = 39 ; Br = 80).
-
Problema de estequiometría 0009
El cinc es atacado por el ácido clorhídrico y su reacción desprende hidrógeno. Si una muestra de 15 g se hace reaccionar con ácido en exceso y libera 3,44 L de hidrógeno medidos a 27 ºC y 1 atm:
a) ¿Cuál es la riqueza de la muestra?
b) ¿Qué volumen de ácido 0,3 M haría falta para tratar 1,5 g de muestra?
Datos: Zn = 65,4 u ; Cl = 35,5 u ; H = 1 u ; R = 0,082 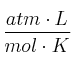
-
Problema reacciones 0013
El hidrógeno (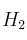 ) es un magnífico reductor que es capaz de reaccionar con el óxido de cobre (II) (CuO) para dar cobre metálico y agua. Determina la cantidad de agua que se producirá si se hacen reaccionar 1,3 moles del óxido con exceso de hidrógeno.
) es un magnífico reductor que es capaz de reaccionar con el óxido de cobre (II) (CuO) para dar cobre metálico y agua. Determina la cantidad de agua que se producirá si se hacen reaccionar 1,3 moles del óxido con exceso de hidrógeno.
 Reacciones químicas
Reacciones químicas