-
Refuerzo: ecuaciones químicas ajustadas (6247)
Escribe una ecuación química ajustada para cada reacción:
a) El aluminio reaccionando con el bromo.
b) El sodio reaccionando con el cloro.
c) El hidróxido de aluminio y el ácido acético reaccionando para producir acetato de aluminio y agua.
d) El amoniaco y el oxígeno reaccionando para producir monóxido de nitrógeno y agua.
e) El nitrógeno y el hidrógeno reaccionando a temperatura y presión elevadas para producir amoniaco.
-
Ampliación: balanceo de ecuaciones químicas (6228)
Balancea las siguientes ecuaciones correctamente:
a) 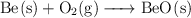
b) 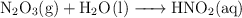
c) 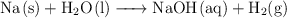
d) 
e) 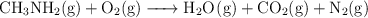
f) 
-
Masa de hidróxido de calcio necesaria para reaccionar con una masa de HCl (4746)
Calcula la masa de hidróxido de calcio necesaria para reaccionar con 16.5 g de ácido clorhídrico.
Datos: Ca = 40 ; H = 1 ; Cl = 35.5 ; O = 16.
-
Yoduro de plomo(II) que se obtiene en una reacción (4745)
Calcula la masa de yoduro de plomo(II) que se obtendrá al hacer reaccionar 15 g de yoduro de potasio con un exceso de nitrato de plomo(II). Ten en cuenta que en la reacción también se produce nitrato de potasio.
Datos: K = 39 ; I = 127 ; Pb = 207.
-
Reactivo limitante y masa de productos obtenidos al reaccionar vidrio con HF (6182)
El ácido fluorhídrico no se puede guardar en frascos de vidrio porque algunos de sus componentes, como el silicato de sodio, reaccionan con él según la siguiente reacción:
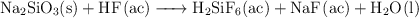
a) Ajusta la reacción.
b) Si disponemos de un recipiente de vidrio que tiene una masa de 25.00 g, que contiene un 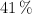 de silicato de sodio, ¿cuál es la masa de este sustancia que está formando el recipiente?
de silicato de sodio, ¿cuál es la masa de este sustancia que está formando el recipiente?
c) Si añadimos 22 g de  al recipiente: indica cuál es el reactivo limitante y calcula cuántos gramos de
al recipiente: indica cuál es el reactivo limitante y calcula cuántos gramos de 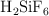 y fluoruro de sodio se producirán en la reacción?
y fluoruro de sodio se producirán en la reacción?
Masas atómicas: Si = 28, F = 19, Na = 23, H = 1, O = 16.
 Ajuste
Ajuste